题目内容
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 15 g-CH3(甲基)含有中子数为6 NA | |
| B. | 5.6 g Fe粉完全溶于HCl和H2SO4的混合稀溶液,生成气体分子的数目为0.1 NA | |
| C. | 标准状况下,2.24 L NO2与N2O4的混合气体中含有氮原子的数目为0.1 NA | |
| D. | 在过氧化钠与CO2的反应中,每生成0.1 mol氧气,转移电子的数目为0.4 NA |
分析 A、求出甲基的物质的量,然后根据1mol甲基中含6mol中子来分析;
B、求出铁的物质的量,然后根据1mol铁和H+反应时,生成1mol氢气来分析;
C、等物质的量的NO2与N2O4中含有的N原子个数不同;
D、过氧化钠和二氧化碳的反应中,氧元素的价态由-1价变为0价.
解答 解:A、15g甲基的物质的量为1mol,而1mol甲基中含6mol中子,故含6NA个,故A正确;
B、5.6g铁的物质的量为0.1mol,而1mol铁和H+反应时,生成1mol氢气,故0.1mol铁生成的氢气分子为0.1NA个,故B正确;
C、等物质的量的NO2与N2O4中含有的N原子个数不同,故标况下2.24L混合气体即0.1mol混合气体中,含有的N原子个数介于0.1NA到0.2NA之间,故C错误;
D、过氧化钠和二氧化碳的反应中,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时,转移电子0.2NA个,故D错误.
故选AB.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
2.在某无色透明强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Cu2+、NO3-、SO32- | B. | Al3+、NH4+、NO3-、Cl- | ||
| C. | K+、Na+、Cl-、SiO32- | D. | K+、Na+、AlO2-、Cl- |
3.下列实验过程中产生的现象与对应的图形相符合的是( )
| A. | 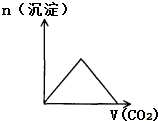 CO2通入KOH和Ca(OH)2的混合稀溶液 | B. | 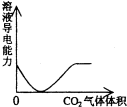 CO2通入澄清石灰水中 | ||
| C. | 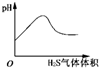 H2S气体通入氯水中 | D. |  NaOH溶液滴入Ba(HCO3)2溶液中 |
7.下列说法错误的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | B. | 乙酸的分子式为:C2H4O2 | ||
| C. | 乙醛的结构简式:CH3COH | D. | 比例模型 可以表示CO2 分子 可以表示CO2 分子 |
17.屠呦呦因发现了青蒿素这种抗疟良药而获得2015年诺贝尔奖,这充分说明了“化学让人们生活更美好”.下列不属于化学反应在生活中的应用的是( )
| A. | 将氧化铁添加到油漆中制红色油漆 | B. | 用氯气给自来水消毒 | ||
| C. | 将粘土烧制成精美的瓷器 | D. | 用食醋清洗水壶中的水垢 |
4.下列判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O2、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物.
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O2、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物.
| A. | 只有①②④⑤ | B. | 只有①②⑤ | C. | 只有②⑤ | D. | 只有②④⑥ |
1.下列关于有机物的说法正确的是( )
| A. |  的分子式为C7H12O 的分子式为C7H12O | |
| B. |  的所有原子一定在同一平面上 的所有原子一定在同一平面上 | |
| C. |  能发生还原反应、氧化反应和取代反应 能发生还原反应、氧化反应和取代反应 | |
| D. |  的二氯代物有15种 的二氯代物有15种 |
2.高效能电池的研发制约电动汽车的推广.有一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,有关此电池的推断正确的是( )
| A. | 负极反应为:14H2O+7O2+28e-═28OH- | |
| B. | 放电过程中KOH的物质的量浓度不变 | |
| C. | 每消耗1molC2H6,则电路上转移的电子为14mol | |
| D. | 放电一段时间后,负极周围的pH升高 |
 )是一种天然抗癌药物,在一定条件下能发生如下转化:
)是一种天然抗癌药物,在一定条件下能发生如下转化:
 .
. .
. .
. (写出一种即可)
(写出一种即可)