题目内容
2.在某无色透明强酸性溶液中,能大量共存的离子组是( )| A. | K+、Cu2+、NO3-、SO32- | B. | Al3+、NH4+、NO3-、Cl- | ||
| C. | K+、Na+、Cl-、SiO32- | D. | K+、Na+、AlO2-、Cl- |
分析 强酸性溶液中,含大量的H+,根据离子之间不能结合生成水、气体、沉淀等,并结合离子的颜色来解答.
解答 解:A.Cu2+为蓝色,与题目无色要求不符,故A错误;
B.溶液无色,离子之间不发生任何反应,可大量共存,故B正确;
C.酸性条件下SiO32-不能大量共存,故C错误;
D.酸性条件下,AlO2-不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存,为高考常见题型,侧重复分解反应的考查,注意归纳常见离子的颜色,把握常见离子的性质和反应类型,题目难度不大.

练习册系列答案
相关题目
7.以葡萄糖为燃料的微生物燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )


| A. | 燃料电池的正极反应式为:O2+2H2O+4e-=4OH- | |
| B. | 装置中NaOH溶液的作用是吸收产生的有毒气体氯气 | |
| C. | 装置中的电子流动路径为:负极→外电路→阴极→苦卤水→阳极→正极 | |
| D. | 理论上,当b 极周围产生2g H2,电池消耗C6H12O6的质量为15g |
13.据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式为HC≡C-C≡C-C≡C-C≡N对该物质的判断不正确的是( )
| A. | 其分子中的原子都在一条直线上 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应 | D. | 可由乙炔和含氮化合物加聚制得 |
17.下列实验方案不合理的是( )
| A. | 鉴别葡萄糖溶液和淀粉溶液:加入新制的Cu(OH)2悬浊液加热或加碘水 | |
| B. | 鉴别织物成分是真丝还是人造丝:用灼烧的方法 | |
| C. | 鉴别淀粉溶液和蛋白质溶液:加入稀KI溶液 | |
| D. | 鉴别乙烷和乙烯:分别将气体通入溴水中 |
7.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
| A. | NH3,K2O,C4H10 | B. | CH4,CO2,H2SO4 | C. | SO2,SiO2,P2O5 | D. | CCl4,Na2S,H2O2 |
11.NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.5L 1 mol•L-1NaHS溶液中,Na+和HS-离子数之和为NA | |
| B. | 标准状况下,11.2LCH3CH2OH的分子数为0.5NA | |
| C. | 0.1mol由16O2和18O2组成的氧气中含有氧原子的数目为0.2NA | |
| D. | Na2O2和Na2S的固体混合物7.8g,其中Na+数为0.3NA |
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 15 g-CH3(甲基)含有中子数为6 NA | |
| B. | 5.6 g Fe粉完全溶于HCl和H2SO4的混合稀溶液,生成气体分子的数目为0.1 NA | |
| C. | 标准状况下,2.24 L NO2与N2O4的混合气体中含有氮原子的数目为0.1 NA | |
| D. | 在过氧化钠与CO2的反应中,每生成0.1 mol氧气,转移电子的数目为0.4 NA |




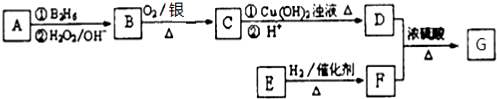
 :
: ;
; ;
;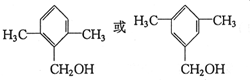 .
.