题目内容
3.下列实验过程中产生的现象与对应的图形相符合的是( )| A. |  CO2通入KOH和Ca(OH)2的混合稀溶液 | B. |  CO2通入澄清石灰水中 | ||
| C. |  H2S气体通入氯水中 | D. |  NaOH溶液滴入Ba(HCO3)2溶液中 |
分析 A.向KOH和Ca(OH)2的混合稀溶液中通入CO2,先二氧化碳和氢氧化钙反应生成碳酸钙沉淀,当氢氧化钙消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,当氢氧化钾完全反应后,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,当碳酸钾反应后,继续通入二氧化碳,二氧化碳和和碳酸钙、水反应生成可溶性的碳酸氢钙;
B.二氧化碳先与氢氧化钙反应生成碳酸钙沉淀,氢氧化钙反应完毕后,二氧化碳再与碳酸根、水生成碳酸氢钙,氢氧化钙与碳酸氢钙的浓度基本相等;
C.H2S气体通入氯水中,发生反应H2S+Cl2=S↓+2HCl,酸性增强;
D.NaOH溶液滴入Ba(HCO3)2溶液中,氢氧根与碳酸氢根发生反应生成碳酸根,碳酸根与钡离子结合生成碳酸钡沉淀.
解答 解:A.向KOH和Ca(OH)2的混合稀溶液中通入CO2,先二氧化碳和氢氧化钙反应生成碳酸钙沉淀,当氢氧化钙消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,当氢氧化钾完全反应后,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,当碳酸钾反应后,继续通入二氧化碳,二氧化碳和和碳酸钙、水反应生成可溶性的碳酸氢钙,图象应为 ,故A错误;
,故A错误;
B.开始二氧化碳与氢氧化钙反应,生成碳酸钙沉淀,溶液中离子浓度降低,导电能力降低,氢氧化钙反应完毕后,二氧化碳再与碳酸根、水生成碳酸氢钙,溶液中离子浓度增大,导电能力增强,最后由钙离子守恒可知氢氧化钙与碳酸氢钙的浓度基本相等,导电能力与开始基本相同,故B正确;
C.H2S气体通入氯水中,发生反应H2S+Cl2=S↓+2HCl,酸性增强,溶液pH值减小,故C错误;
D.NaOH溶液滴入Ba(HCO3)2溶液中,立即生成碳酸钡沉淀,故D错误.
故选B.
点评 本题以图象题形式考查物质之间的反应,侧重于学生的分析能力的考查,题目难度中等,根据反应过程判断,注意BD都是与量有关的反应,量不同导致产物不同.

 阅读快车系列答案
阅读快车系列答案| A. | 其分子中的原子都在一条直线上 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应 | D. | 可由乙炔和含氮化合物加聚制得 |
| A. | 0.5L 1 mol•L-1NaHS溶液中,Na+和HS-离子数之和为NA | |
| B. | 标准状况下,11.2LCH3CH2OH的分子数为0.5NA | |
| C. | 0.1mol由16O2和18O2组成的氧气中含有氧原子的数目为0.2NA | |
| D. | Na2O2和Na2S的固体混合物7.8g,其中Na+数为0.3NA |
已知:①.NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-═Ni(OH)2+2OH-,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+.过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
| A. | 除去苯中少量苯酚,加入适量浓溴水,过滤 | |
| B. | 除去乙烷中的乙烯,把混合气体通入酸性高锰酸钾溶液中 | |
| C. | 除去丁醇中的乙醚,用蒸馏法 | |
| D. | 提纯蛋白质时可先加入(CH3COO)2Pb溶液,过滤后再加水重新溶解 |
| A. | 石灰乳中通入Cl2制漂白精的离子反应方程式为:4OH-+2Ca2++2Cl2═2Cl-+Ca(ClO)2↓+2H2O | |
| B. | NaHCO3中滴入少量Ba(OH)2溶液,其离子方程式正确的是:H++CO32-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 1.0 mol•L-1的KNO3溶液中H+、Fe2+、Cl-、SO42- 能大量共存 | |
| D. | pH=12的溶液中K+、Na+、CH3COO-、Br-能大量共存 |
| A. | 15 g-CH3(甲基)含有中子数为6 NA | |
| B. | 5.6 g Fe粉完全溶于HCl和H2SO4的混合稀溶液,生成气体分子的数目为0.1 NA | |
| C. | 标准状况下,2.24 L NO2与N2O4的混合气体中含有氮原子的数目为0.1 NA | |
| D. | 在过氧化钠与CO2的反应中,每生成0.1 mol氧气,转移电子的数目为0.4 NA |
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol•L-1 NaOH溶液中加入几滴1mol•L-1 MgCl2溶液,生成白色沉淀,再加入几滴1mol•L-1 FeCl3溶液 |
| D | 硅酸胶体的制备 | 向Na2SiO3溶液(饱和溶液1:2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失 |
| A. | A | B. | B | C. | C | D. | D |

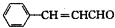 :
: ;
; ;
;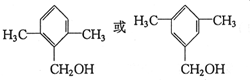 .
.