题目内容
2.高效能电池的研发制约电动汽车的推广.有一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,有关此电池的推断正确的是( )| A. | 负极反应为:14H2O+7O2+28e-═28OH- | |
| B. | 放电过程中KOH的物质的量浓度不变 | |
| C. | 每消耗1molC2H6,则电路上转移的电子为14mol | |
| D. | 放电一段时间后,负极周围的pH升高 |
分析 原电池中通入燃料的电极是负极,通入氧气的电极是正极,电解质溶液呈碱性,负极反应式为:C2H6+18OH--14e-═2CO32-+12H2O,正极反应式为2H2O+O2+4e-═4OH-,根据电极反应可以确定电子转移情况以及电极附近溶液的酸碱性变化情况.
解答 解:A.负极上乙烷失电子发生氧化反应,电极反应式为C2H6+18OH--14e-═2CO32-+12H2O,正极反应式为2H2O+O2+4e-═4OH-,故A错误;
B.该反应中有水生成,导致溶液体积增大,KOH参加反应导致物质的量减少,所以KOH浓度降低,故B错误;
C.根据C2H6+18OH--14e-═2CO32-+12H2O可知,每消耗1molC2H6,则电路上转移的电子为14mol,故C正确;
D.放电过程中,负极上氢氧根离子参加反应导致浓度降低,所以碱性减弱,PH下降,故D错误;
故选:C.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度不大.

练习册系列答案
相关题目
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 15 g-CH3(甲基)含有中子数为6 NA | |
| B. | 5.6 g Fe粉完全溶于HCl和H2SO4的混合稀溶液,生成气体分子的数目为0.1 NA | |
| C. | 标准状况下,2.24 L NO2与N2O4的混合气体中含有氮原子的数目为0.1 NA | |
| D. | 在过氧化钠与CO2的反应中,每生成0.1 mol氧气,转移电子的数目为0.4 NA |
13.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol•L-1 NaOH溶液中加入几滴1mol•L-1 MgCl2溶液,生成白色沉淀,再加入几滴1mol•L-1 FeCl3溶液 |
| D | 硅酸胶体的制备 | 向Na2SiO3溶液(饱和溶液1:2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失 |
| A. | A | B. | B | C. | C | D. | D |
7.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成:

下列说法正确的是( )

下列说法正确的是( )
| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 通常条件下,咖啡酸和苯乙醇都能发生取代、加成、消去、氧化反应 | |
| C. | 1molCPAE与H2反应,最多可消耗8molH2 | |
| D. | 可用FeCl3溶液检测上述反应是否有CPAE生成 |
14.下列说法正确的是( )
| A. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-丙基戊烷 | |
| B. | 已知C-C键可以绕键轴自由旋转,结构简式为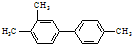 分子中至少有7个碳原子处于同一直线上 分子中至少有7个碳原子处于同一直线上 | |
| C. | 肌醇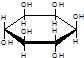 与葡萄糖 与葡萄糖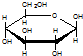 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 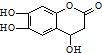 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 |
11.下列叙述错误的是( )
| A. | 氦气可用于填充飞艇 | B. | 氯化铁可用于硬水的软化 | ||
| C. | 石英砂可用于生产单晶硅 | D. | 聚四氟乙烯可用于厨具表面涂层 |
2.工业上可用如图装置测定黄铁矿(主要成分为FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
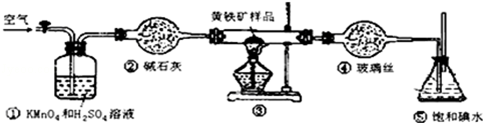
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用200mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
则硫铁矿样品中硫元素的质量分数为16.0%(保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂D.
A.硝酸银溶液 B.氯化钙溶液 C.澄清石灰水 D.氯化钡溶液.

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用200mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂D.
A.硝酸银溶液 B.氯化钙溶液 C.澄清石灰水 D.氯化钡溶液.

 +R-Mgx→
+R-Mgx→ $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$ (R代表烃基,X代表卤素原子)
(R代表烃基,X代表卤素原子) .
. .
. 是合成感冒药物中的一种原料,实验室可用环己烯按以下合成路线合成该有机物:
是合成感冒药物中的一种原料,实验室可用环己烯按以下合成路线合成该有机物:
 ;Z
;Z .
.