题目内容
5.下列说法中正确的是( )| A. | 铵盐都易溶于水 | |
| B. | 铵盐受热分解都能得到氨气 | |
| C. | 除去NH4Cl溶液中少量的CaCl2,加过量的NH4HCO3溶液后过滤 | |
| D. | 铵盐与碱液共热都能生成使蓝色石蕊试变红的气体 |
分析 A.铵盐都是可溶性的强电解质;
B、硝酸铵分解生成氮气,不会得到氨气;
C、除去NH4Cl溶液中少量的CaCl2,加入适量的碳酸铵,而不是碳酸氢铵;
D、铵盐与强碱反应共热会生成氨气,氨气是碱性气体.
解答 解:A.铵盐都是可溶性的强电解质,所以铵盐都易溶于水,故A正确;
B、硝酸铵分解生成氮气,不会得到氨气,所以铵盐受热分解不一定生成氨气,故B错误;
C、除去NH4Cl溶液中少量的CaCl2,加入适量的碳酸铵,而不是碳酸氢铵,因为碳酸氢钙易溶于水,故C错误;
D、铵盐与强碱反应共热会生成氨气,氨气是碱性气体,能使红色石蕊试变蓝,故D错误;
故选A.
点评 本题考查学生铵盐的物理性质和化学性质等知识,可以根据所学知识来回答,难度不大.

练习册系列答案
相关题目
6.CH2=CH2与CH2=CR2(R为烃基)的混合物在一定条件下发生加聚反应,生成的产物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
7.X、Y、Z、M、N、q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是( )
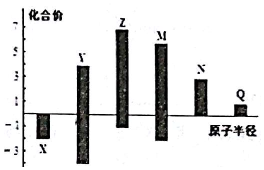

| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>X>Y |
10.化学与社会、科学、技术、环境(STSE)密切联系.下列说法正确的是( )
| A. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| B. | 手机外壳上贴的碳纤维外膜是一种新型无机非金属材料 | |
| C. | 用淀粉溶液可以直接检验海水中是否含碘元素 | |
| D. | 明矾净水的原理和“84”消毒液消毒的原理相同 |
17.下列有关金属及其合金的说法不正确的是( )
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| C. | 出土的古代铜制品表面覆盖着铜绿其主要成分为 CuO | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
14.下列化学用语表示正确的是( )
| A. | 乙炔球棍模型: | B. | 质量数为的37的原子${\;}_{37}^{17}$Cl | ||
| C. | 氯化镁电子式: | D. | 氯离子的结构示意图: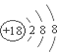 |
15.下列有关晶体的说法中正确的是( )
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 分子间作用力越大,分子越稳定 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 原子晶体中共价键越强,熔点越高 |