题目内容
汽车用铅蓄电池中需要质量分数为28%的稀硫酸.若在实验室中用10g 质量分数为98%的浓硫酸(密度为1.84g/cm3)配制28%的稀硫酸,下列做法或说法正确的是(水的密度近似看作1g/cm3)( )
| A、将25mL水慢慢倒入盛有5.4mL浓硫酸的量筒中,并用玻璃棒不断搅拌 |
| B、将10g98%的浓硫酸沿烧杯壁慢慢注入盛有25mL水的烧杯中,并用玻璃棒不断搅拌 |
| C、若其他操作正确,量取25mL水时俯视读数,则所配稀硫酸中溶质的质量分数小于28% |
| D、配制该溶液时,若有浓硫酸沾到手上应立即用氢氧化钠溶液中和 |
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:A、量筒是用于量取一定体积液体的仪器,不可在量筒内进行溶液的配制;
B、利用溶洞质的质量分数的计算公式,计算所得溶液的溶质质量分数是否为28%;
C、俯视读数时,所读的体积数大于实际液体的体积,因此,量取水的体积小于25mL;
D、氢氧化钠有极强的腐蚀性,同样会对手造成腐蚀,处理方法不正确.
B、利用溶洞质的质量分数的计算公式,计算所得溶液的溶质质量分数是否为28%;
C、俯视读数时,所读的体积数大于实际液体的体积,因此,量取水的体积小于25mL;
D、氢氧化钠有极强的腐蚀性,同样会对手造成腐蚀,处理方法不正确.
解答:
解:A、将25mL水慢慢倒入盛有5.4mL浓硫酸的量筒中,并用玻璃棒不断搅拌,在量筒内进行溶解操作是操作要求所不允许的,故A错误;
B、所得溶液的溶质质量分数=
×100%=28%,故B正确;
C、俯视读数时所量取的水的体积小于25mL,溶剂量偏小所得溶液的溶质质量分数则偏大,故C错误;
D、浓硫酸沾到手上应用布擦拭后再用大量水冲洗,应该直接用大量的水清洗然后图上3%-5%的碳酸氢钠溶液,不可用腐蚀性同样极强的氢氧化钠进行中和处理,故D错误;
故选B.
B、所得溶液的溶质质量分数=
| 10g×98% |
| 10g+25g |
C、俯视读数时所量取的水的体积小于25mL,溶剂量偏小所得溶液的溶质质量分数则偏大,故C错误;
D、浓硫酸沾到手上应用布擦拭后再用大量水冲洗,应该直接用大量的水清洗然后图上3%-5%的碳酸氢钠溶液,不可用腐蚀性同样极强的氢氧化钠进行中和处理,故D错误;
故选B.
点评:本题考查溶液的配制,注意量筒只能用于量取一定体积的液体,不可用作反应容器;在使用量筒量取液体读数时就平视,视线与凹液面最低处保持在同一水平面上.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
在反应:3BrF3+5H2O═HBrO3+Br2+O2+9HF中(已知BrF3中Br为+3价,F为-1价),当有2mol水参加氧化还原反应时,由水还原的BrF3和总的被还原的BrF3物质的量分别是( )
| A、1mol、3mol |
| B、2mol、3mol |
| C、4/3mol、2mol |
| D、3mol、1mol |
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br-- |
| B、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| C、Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
| D、pH=12的溶液中:NO3-、I-、Na+、Al3+ |
当我们经过花园时,常常闻到花的香味,其原因是( )
| A、分子很小 |
| B、分子是由原子构成的 |
| C、气体分子间有较大间隔 |
| D、分子在不停地运动 |
下列化学用语或模型图正确的是( )
| A、1-丁醇的结构简式:C4H10O |
B、四氯化碳的电子式: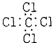 |
C、C2H4的比例模型: |
D、14C的原子结构示意图: |
Na2O与Na2O2混合物共2mol,与足量盐酸反应,消耗盐酸的物质的量是( )
| A、2mol | B、3mol |
| C、4mol | D、无法判断 |
