题目内容
12.已知X、Y是主族元素,I为电离能,单位是kJ/mol.请根据下表所列数据判断,错误的( )| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 若元素Y处于第三周期,它可与冷水剧烈反应 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氧形成化合物时,化学式可能是X2O或X2O2 | |
| D. | 元素X的常化合价是+1 |
分析 X、Y是主族元素,I为电离能,X第一电离能和第二电离能差距较大,说明X为第IA族元素;
Y第三电离能和第四电离能差距较大,说明Y为第IIIA族元素,X的第一电离能小于Y,说明X的金属活泼性大于Y,结合物质性质分析解答.
解答 解:A.Y第三电离能和第四电离能差距较大,说明Y为第IIIA族元素,若元素Y处于第3周期,为Al元素,它不能与冷水剧烈反应,但能溶于酸和强碱溶液,故A错误;
B.Y第三电离能和第四电离能差距较大,说明Y为第IIIA族元素,故B正确;
C.X第一电离能和第二电离能差距较大,说明X为第IA族元素,元素X与氧形成化合物时,化学式可能是X2O或X2O2,如:H2O或H2O2,Na2O或Na2O2,故C正确;
D.X第一电离能和第二电离能差距较大,说明X为第IA族元素,元素最高化合价与其族序数相等,所以X常见化合价为+1价,故D正确;
故选A.
点评 本题考查元素电离能和原子结构关系,正确推断元素在周期表中的位置是解本题关系,灵活运用基本概念、基本理论结合物质结构、性质解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.设NA为阿伏加德罗常数的值,下列有关叙述错误的是( )
| A. | 1mol H2O2与足量KMnO4反应,转移电子数为2NA | |
| B. | 4.4g CO2和N2O的混合气体含有的原子数为0.3NA | |
| C. | 22.4L NH3含有的电子数为10NA | |
| D. | 25℃、101kPa,2.24LCH4含有的共价键数小于0.4NA |
9.下列实验能达到实验目的是( )
| A. | 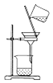 用装置分离Fe(OH)3胶体和NaCl溶液 | |
| B. | 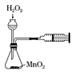 用装置定量测定H2O2的分解速率 | |
| C. |  用装置将CuSO4•5H2O变无水CuSO4 | |
| D. | 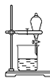 用装置④分离饱和Na2CO3溶液和CH3COOCH2CH3 |
6.下列关于铝热反应实验中涉及的化学方程式正确的是( )
| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 3Mg+Fe2O3═3MgO+2Fe | D. | Al+Fe2O3═Al2O3+Fe |
7.标准状况下的甲烷和一氧化碳的混合气体8.96L,其质量为7.60g,则混合气体的物质的量为:0.4mol,平均摩尔质量为19g/mol;混合气体中甲烷的体积为6.72L;一氧化碳的质量为2.8g.
17.化学是你,化学是我,化学深入我们生活,下列说法正确的是( )
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 煤是混合物,含有大量的芳香烃 |
4.工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸.反应历程如图所示:下列说法不正确的是( )


| A. | 氨可用作制冷剂 | |
| B. | 铵态氮肥一般不能与碱性化肥混合使用 | |
| C. | 硝酸可用于制化肥、农药、炸药、染料、盐类等 | |
| D. | 某浓硝酸中含有溶质2 mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1 mol NO2 |
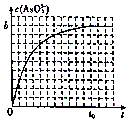 砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题:
砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题: .
.