题目内容
10. 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1(1)判断该可逆反应达到平衡状态的标志是cd(填字母序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol•L-1,此时对应的温度为250℃;CO的转化率为80%.
(3)要提高CO的转化率,可以采取的措施是df(填字母序号).
a.升温 b.加入催化剂
c.增加CO的浓度 d.通入H2加压
e.通入惰性气体加压 f.分离出甲醇
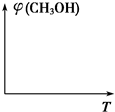
(4)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出p1、p2,且p1<p2).
分析 (1)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(2)①升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
②转化率=$\frac{n(CO)(反应)}{n(CO)(反应开始)}$,根据平衡浓度计算出平衡常数来确定温度;
(3)要提高CO的转化率,必须使可逆反应向正反应方向移动;
(4)根据压强对平衡移动的影响判断;
解答 解:(1)a.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故错误;
b.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
c.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;
d.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故正确;
故选 cd;
(2)①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
②平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率=$\frac{n(CO)(反应)}{n(CO)(反应开始)}$=$\frac{(1-0.4)mol}{2mol}$=80%,
CO(g)+2H2(g)?CH3OH(g)单位为mol/L
开始 (mol/L):1mol/L 3mol/L 0
反应(mol/L):0.8mol/L 1.6mol/L 0.8mol/L
平衡(mol/L):0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=$\frac{0.8mol/L}{0.2mol/L×(1.4mol/L)^{2}}$=2.04,所以是250℃;
故答案为:250℃;80%;
(3)a.该反应是放热反应,升高温度平衡向逆反应方向移动,故错误;
b.催化剂对平衡移动无影响,故错误;
c.增加CO的浓度,平衡向正反应方向移动,但CO的转化率降低,故错误;
d.加入H2加压,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
e.加入惰性气体加压,参加反应的气体压强不变,平衡不移动,故错误;
f.分离出甲醇,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
故选df;
(4)CO(g)+2H2(g)?CH3OH(g)△H<0,
则温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
压强增大,反应正向进行的程度大,则甲醇的含量高,则图象为 ,
,
故答案为: .
.
点评 本题考查了影响化学平衡移动的因素、平衡状态的判断等知识点,易错选项是(3)C,注意加入CO虽然能使平衡向正反应方向移动,但一氧化碳的转化率降低,为易错点.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案(1)铜元素在元素周期表中的位置为第四周期ⅠB族,Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,基态铜原子核外电子共有29种运动状态.
(2)Cu2S在一定条件下可被氧化为CuSO4.
①在SO42-中S原子的杂化轨道类型为sp3;SiO44-、PO43-与 SO42-互为等电子体;其中Si、P、S第一电离能由大到小顺序为P>S>Si;
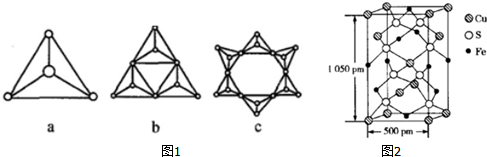
②硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以用图1a 表示,图1中b、c 是硅氧四面体结合成环状结构的两个例子,若在环状结构中硅的原子数为n,写出环状结构中硅酸根离子的通式SinO3n2n-.
(3)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH),二者部分物理性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 水溶液 |
| 甲醇 | -97 | 64.7 | 互溶 |
| 甲硫醇 | -123 | 6.8 | 不溶 |
(4)某化合物由S、Fe、Cu 三种元素组成,其晶胞结构如图2所示(1pm=10-10cm),该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度ρ=4.66g/cm3(保留三位有效数字).
| A. | H2O | B. | CH3OH | C. | CS2 | D. | CH3COOH |
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| D. | 锌铜原电池中,锌做负极,发生还原反应 |
| A. | 18 g H2O所含的分子数为NA | |
| B. | 22.4 L H2O所含的分子数为NA | |
| C. | NA个氢原子的质量为2 g | |
| D. | 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl- |
| A. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| C. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 | |
| D. | “血液透析”利用了胶体的性质 |