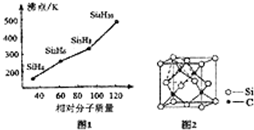
题目内容
15.下列物质转化在给定条件下不能实现的是( )①Si$→_{△}^{O_{2}}$SiO2$\stackrel{H_{2}O}{→}$H2SiO3
②S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4
③C$→_{点燃}^{SiO_{2}}$CO2$\stackrel{NaOH}{→}$Na2CO3
④Na$→_{△}^{O_{2}}$Na2O2$\stackrel{H_{2}O}{→}$NaOH.
| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
分析 ①硅燃烧生成二氧化硅,二氧化硅不溶于水不能直接生成硅酸;
②硫单质点燃反应生成二氧化硫,不能一步生成三氧化硫;
③碳高温和二氧化硅反应生成一氧化碳,二氧化碳通入氢氧化钠溶液生成碳酸钠和水;
④钠加热和氧气反应生成过氧化钠,过氧化钠和水反应生成氢氧化钠和氧气;
解答 解:①硅燃烧生成二氧化硅,Si+O2$\frac{\underline{\;\;△\;\;}}{\;}$SiO2,二氧化硅不溶于水不能直接生成硅酸,给定条件下不能实现,故①符合;
②硫单质点燃反应生成二氧化硫,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,不能一步生成三氧化硫,给定条件下不能实现,故②符合;
③碳高温和二氧化硅反应生成一氧化碳,2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,不生成二氧化碳,给定条件下不能实现,故③符合;
④钠加热和氧气反应生成过氧化钠,2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,过氧化钠和水反应生成氢氧化钠和氧气,2Na2O2+2H2O=4NaOH+O2,给定条件下能实现,故④不符合;
故选C.
点评 本题考查了硅、硫、碳、钠及其化合物性质,主要是反应条件和反应产物的分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.现有部分短周期元素的性质或原子结构如下表:
(1)写出A元素在周期表中的位置第三周期第ⅥA族.
(2)写出C元素气态氢化物的电子式 .
.
(3)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中 能证明这一事实的是b(填选项序号).
a.常温下D的单质和A的单质状态不同 b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
(4)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物 的水化物中化学性质明显不同于其他三种酸的是H2CO3(写化学式).
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,且K、M层电子数之和等于L层电子数 |
| B | 最外层电子数是次外层电的2倍 |
| C | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
(2)写出C元素气态氢化物的电子式
 .
.(3)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中 能证明这一事实的是b(填选项序号).
a.常温下D的单质和A的单质状态不同 b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
(4)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物 的水化物中化学性质明显不同于其他三种酸的是H2CO3(写化学式).
6.下列各组物质间的转化关系正确的是( )
| A. | FeCl2(aq)$\stackrel{Cl_{2}}{→}$FeCl3(aq)$\stackrel{Cu}{→}$FeCl2(aq) | B. | H2SO3$\stackrel{△}{→}$Si02$\stackrel{HCl}{→}$SiCl4 | ||
| C. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHC03(s)$\stackrel{△}{→}$Na2CO3(s) | D. | CuS04 $\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{乙醛}$Cu |
10.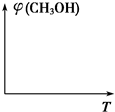 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
(1)判断该可逆反应达到平衡状态的标志是cd(填字母序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
①由表中数据判断Q<0(填“>”、“<”或“=”).
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol•L-1,此时对应的温度为250℃;CO的转化率为80%.
(3)要提高CO的转化率,可以采取的措施是df(填字母序号).
a.升温 b.加入催化剂
c.增加CO的浓度 d.通入H2加压
e.通入惰性气体加压 f.分离出甲醇
(4)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出p1、p2,且p1<p2).
 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1(1)判断该可逆反应达到平衡状态的标志是cd(填字母序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol•L-1,此时对应的温度为250℃;CO的转化率为80%.
(3)要提高CO的转化率,可以采取的措施是df(填字母序号).
a.升温 b.加入催化剂
c.增加CO的浓度 d.通入H2加压
e.通入惰性气体加压 f.分离出甲醇
(4)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出p1、p2,且p1<p2).
20.在沥青中有一系列稠环化合物,它们彼此虽不是同系物,但其组成和结构都有规律性的变化,从萘开始,这一系列化合物中第25个分子式是( )


| A. | C50H30 | B. | C154H56 | C. | C154H60 | D. | C150H56 |
7.试预测下列哪些物质不具备漂白性( )
| A. | 氯水 | B. | (CaCl2)氯化钙溶液 | ||
| C. | 漂白粉溶液 | D. | (NaClO)次氯酸钠溶液 |
5.化学与生产、生活密切相关,下列应用与水解原理无关的是( )
| A. | 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞 | |
| B. | 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫 | |
| C. | 用氯化铵溶液除去铁锈 | |
| D. | 可用碳酸钠与醋酸制取少量二氧化碳 |