题目内容
5.下列说法正确的是( )| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| D. | 锌铜原电池中,锌做负极,发生还原反应 |
分析 A.负极Fe失去电子;
B.正极上氧气得到电子;
C.用惰性电极电解饱和食盐水时,阳极上氯离子失去电子;
D.锌铜原电池中,活泼金属作负极,失去电子发生氧化反应.
解答 解:A.钢铁发生电化腐蚀的负极反应式为Fe-2e-=Fe2+,析氢腐蚀时正极上氢离子得到电子,吸氧腐蚀时正极上氧气得到电子,故A错误;
B.电解质为碱时,氢氧燃料电池的正极反应式为O2+2H2O+4e-=4OH-,电解质为酸时,正极反应为O2+OH++4e-=2H2O,故B错误;
C.用惰性电极电解饱和食盐水时,阳极时氯离子失去电子,阳极的电极反应式为2Cl--2e-=Cl2↑,故C正确;
D.锌铜原电池中,锌做负极,发生氧化反应,故D错误;
故选C.
点评 本题考查原电池及金属的腐蚀与防护,为高频考点,把握原电池原理、电极反应及原电池的应用为解答的关键,侧重分析与应用能力的考查,注意电极反应的书写,题目难度不大,

练习册系列答案
相关题目
5.W、X、Y、Z、N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是( )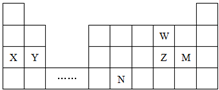

| A. | 原子半径:X>Y>W | |
| B. | 单质的氧化性:W>Z | |
| C. | 溴与元素M同主族,气态氢化物的稳定性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
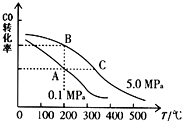
10. 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
(1)判断该可逆反应达到平衡状态的标志是cd(填字母序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
①由表中数据判断Q<0(填“>”、“<”或“=”).
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol•L-1,此时对应的温度为250℃;CO的转化率为80%.
(3)要提高CO的转化率,可以采取的措施是df(填字母序号).
a.升温 b.加入催化剂
c.增加CO的浓度 d.通入H2加压
e.通入惰性气体加压 f.分离出甲醇
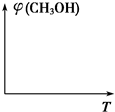
(4)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出p1、p2,且p1<p2).
 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1(1)判断该可逆反应达到平衡状态的标志是cd(填字母序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol•L-1,此时对应的温度为250℃;CO的转化率为80%.
(3)要提高CO的转化率,可以采取的措施是df(填字母序号).
a.升温 b.加入催化剂
c.增加CO的浓度 d.通入H2加压
e.通入惰性气体加压 f.分离出甲醇
(4)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出p1、p2,且p1<p2).
15.下列化学反应中属于取代反应的是( )
| A. | C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | |
| B. | CH3OH+HCl→CH3Cl+H2O | |
| C. | (NH4)2SO4+BaCl2═BaSO4↓+2NH4Cl | |
| D. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O |
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题: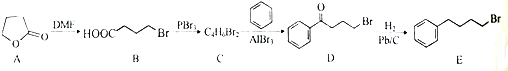
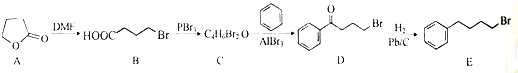
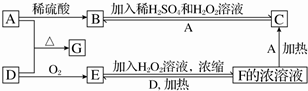
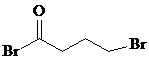 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.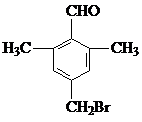 等.
等.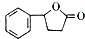 的合成路线流程图(无机试剂任用).合成路线流程图示例如下
的合成路线流程图(无机试剂任用).合成路线流程图示例如下 .(不考虑空间构型)
.(不考虑空间构型)