题目内容
对下列物质的叙述,不正确的是( )
| A、金属钠具有强还原性 |
| B、二氧化碳在一定条件下具有氧化性 |
| C、氧气通常具有氧化性而不具有还原性 |
| D、盐酸只具有氧化性 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A.金属在反应中只能失去电子;
B.二氧化碳中C元素的化合价为最高价;
C.氧气在反应中一般得到电子;
D.盐酸中,H为+1价,Cl为-1价,既可失去电子也可得到电子.
B.二氧化碳中C元素的化合价为最高价;
C.氧气在反应中一般得到电子;
D.盐酸中,H为+1价,Cl为-1价,既可失去电子也可得到电子.
解答:
解:A.钠原子的最外层电子数为1,易失去,表现强还原性,故A正确;
B.CO2可与C反应生成CO表现CO2的氧化性,故B正确;
C.O2可将一些单质氧化成氧化物,表现氧化性,它一般不具有还原性,故C正确;
D.因为HCl中H元素化合价可由+1价→0价,Cl元素化合价可由-1价→0价,则盐酸既具有氧化性又具有还原性,故D错误;
故选D.
B.CO2可与C反应生成CO表现CO2的氧化性,故B正确;
C.O2可将一些单质氧化成氧化物,表现氧化性,它一般不具有还原性,故C正确;
D.因为HCl中H元素化合价可由+1价→0价,Cl元素化合价可由-1价→0价,则盐酸既具有氧化性又具有还原性,故D错误;
故选D.
点评:本题考查氧化还原反应,为高考常见题型,把握元素的化合价变化为解答的关键,注意从元素化合价变化角度分析,题目难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
下列离子方程式正确的是( )
A、向NH4HCO3溶液中,加入过量的氢氧化钠溶液,并加热 NH4++OH-
| ||||
| B、FeO加入硝酸中:FeO+2H+═Fe2++H2O | ||||
| C、向次氯酸钠溶液中通入少量SO2气体 2ClO-+SO2+H2O=2HClO+SO32- | ||||
D、实验室制氯气 MnO2+4H++2Cl-
|
设NA为阿伏加德罗常数值,下列说法中正确的是( )
| A、氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子 |
| B、25℃,1.01×105Pa,64gS02中含有的原子数为3NA |
| C、NA个一氧化碳分子和0.5mol甲烷(CH4)的质量比为7:4 |
| D、标准状况下,11.2L氦气所含的原子数为NA |
下列有关钠的叙述中,正确的是( )
| A、钠是银白色金属,硬度很大 |
| B、加热时,金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠 |
| C、金属钠在空气中燃烧,生成氧化钠 |
| D、金属钠的熔点很高 |
需要加入氧化剂才能实现的变化是( )
| A、Cl-→Cl2 | |||||||||
| B、ClO3-→Cl- | |||||||||
C、
| |||||||||
| D、CO32-→CO2 |
下列化学反应的离子方程式书写正确的是( )
| A、氯化铝溶液与过量氨水反应:3NH3?H2O+Al3+=Al(OH)3↓+3NH4+ |
| B、向氢氧化钠溶液中通入过量的CO2气体:CO2+2OH-=CO32-+H2O |
| C、FeCl3溶液与Cu粉反应:Cu+Fe3+═Cu2++Fe2+ |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═Ba SO4↓+H2O |
将1mL甲醛(HCHO)蒸气溶于12mL冰醋酸中,再加入lg果糖和12g葡萄糖,所得混合物中碳元素的质量百分含量是( )
| A、40% | B、44% |
| C、55% | D、无法确定 |
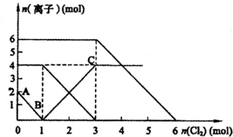 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.