题目内容
17.(1)等物质的量的金属钠分别与足量的H2O、D2O和T2O完全反应,产生H2、D2和T2的质量之比为1:2:3.(2)核内中子数为N的R2+,质量数为A,则n g它的同价态氧化物中所含电子的物质的量为$\frac{n}{A+16}$(A-N+8)mol.
(3)含6.02×1023个中子的${\;}_{3}^{7}$Li的质量是$\frac{7}{4}$g;4g D2和20g 18O2的单质化合时最多能生成22g D218O.这些D218O分子中含有12mol中子,含10个电子.
分析 (1)等物质的量的金属钠分别与足量的H2O、D2O和T2O完全反应生成的氢气的物质的量相同,再根据m=nM计算;
(2)核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,电子数为A-N;该离子带2个单位正电荷,所以其氧化物的化学式为RO,该氧化物的摩尔质量为(A+16)g/mol,一个氧化物分子中含有(A-N+8)个中子;
(3)根据n=$\frac{N}{{N}_{A}}$计算中子物质的量,Li的中子数为7-3=4,进而计算Li的物质的量,再根据m=nM计算;进行过量计算,根据不足量的物质计算生成D2O的质量;根据D2O含有的中子数和电子数计算.
解答 解:(1)等物质的量的金属钠分别与足量的H2O、D2O和T2O完全反应生成的氢气的物质的量相同,设氢气的物质的量为amol,
则H2、D2和T2的质量之比为2a:4a:6a=1:2:3;
故答案为:1:2:3;
(2)该离子带2个单位正电荷,所以其氧化物的化学式为RO,该氧化物的摩尔质量为(A+16)g/mol,n g 它的氧化物的物质的量为$\frac{ng}{(A+16)g/mol}$;
一个氧化物分子中含有(A-N+8)个质子,所以ng它的氧化物中所含质子的物质的量为$\frac{ng}{(A+16)g/mol}$×(A-N+8)=$\frac{n}{A+16}$(A-N+8)mol,质子数与电子数相同,
所以电子的物质的量为:$\frac{n}{A+16}$(A-N+8)mol;
故答案为:$\frac{n}{A+16}$(A-N+8)mol;
(3)6.02×1023个中子物质的量为1mol,Li的中子数为7-3=4,故Li的物质的量为$\frac{1}{4}$mol=0.25mol,Li的质量=0.25mol×7g/mol=$\frac{7}{4}$g;
2D2+18O2 =2 D218O
8 36 44
4g 18g 22g
故氢气不足,根据氢气计算生成D2O的质量=4g×$\frac{44}{8}$=22g;
生成的D218O的物质的量为1mol,则D218O分子中含有中子为12mol,含有电子为10mol;
故答案为:$\frac{7}{4}$;22;12;10.
点评 本题考查了物质的量的计算,题目难度中等,侧重考查学生分析判断及计算能力,注意把握分子或原子中质子数、中子数和电子数的计算方法.

 阅读快车系列答案
阅读快车系列答案| A. | 己烷、己烯和CCl4可以用溴水鉴别 | |
| B. | 除去甲苯中的苯乙烯(C6H5CH═CH2)可以用溴水 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 乙烯和二氧化硫使溴水褪色的原理相同 |
| A. | 烧碱溶液 | B. | 熔融的纯碱 | C. | 氢氟酸 | D. | 盐酸 |
| A. | 一定条件下能与液溴发生取代反应 | B. | 能与溴水反应而褪色 | ||
| C. | 苯存在单双建交替结构 | D. | 苯不能发生加成反应 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 相等 | B. | 前者小 | C. | 前者大 | D. | 不能确定 |
| A. |  | B. |  | ||
| C. |  | D. |  |
 和
和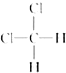 E.正丁烷和异丁烷 F.2,2-二甲基丁烷和正戊烷
E.正丁烷和异丁烷 F.2,2-二甲基丁烷和正戊烷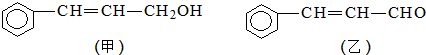
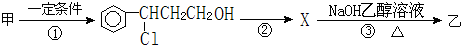
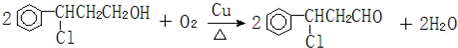 (注明反应条件).
(注明反应条件).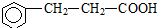 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式 、
、 ,.
,.