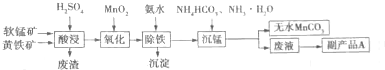
题目内容
将a克Fe2O3 、Al2O3 样品溶解在过量的200mL c(H+)=0.1mol?L-1 的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+ 刚好完全沉淀,用去NaOH溶液100mL,则NaOH 溶液的浓度为( )
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.8 mol?L-1 |
考点:物质的量浓度的相关计算
专题:计算题
分析:反应生成硫酸铝、硫酸铁,且硫酸有剩余,向反应后的混合溶液中加入NaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据硫酸根守恒有n(Na2SO4)=n(H2SO4),根据钠离子守恒有n(NaOH)=2n(Na2SO4),再根据c=
计算.
| n |
| V |
解答:
解:c(H+)=0.1mol?L-1,则c(H2SO4)=
×0.1mol/L=0.05mol/L;
反应生成硫酸铝、硫酸铁,且硫酸有剩余,向反应后的混合溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)=0.2L×0.05mol/L=0.01mol,根据钠离子守恒有n(NaOH)=2n(Na2SO4)=0.01mol×2=0.02mol,则该c(NaOH)=
=0.2mol/L,
故选B.
| 1 |
| 2 |
反应生成硫酸铝、硫酸铁,且硫酸有剩余,向反应后的混合溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)=0.2L×0.05mol/L=0.01mol,根据钠离子守恒有n(NaOH)=2n(Na2SO4)=0.01mol×2=0.02mol,则该c(NaOH)=
| 0.02mol |
| 0.1L |
故选B.
点评:本题考查混合物的计算,明确最后溶液中的溶质是解本题关键,再结合原子守恒来分析解答,侧重考查学生分析问题及解决问题的能力,题目难度中等.

练习册系列答案
相关题目
根据碘与氢气反应的热化学方程式(碘为气态或固态),下列判断正确的是( )
(ⅰ) I2(?)+H2(g)?2HI(g)+9.48kJ (ⅱ) I2(?)+H2(g)?2HI(g)-26.48kJ.
(ⅰ) I2(?)+H2(g)?2HI(g)+9.48kJ (ⅱ) I2(?)+H2(g)?2HI(g)-26.48kJ.
| A、ⅰ中碘为气态,ⅱ中碘为固态 |
| B、反应(ⅰ)的产物比反应(ⅱ)的产物稳定 |
| C、1 mol I2(g)中通入1 mol H2(g),反应放热9.48 kJ |
| D、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
下列反应既属于化合反应,又属于氧化还原反应的是( )
A、CO+CuO
| ||||
| B、2FeCl2+Cl2=2FeCl3 | ||||
| C、CaO+H2O=Ca(OH)2 | ||||
| D、2Al+3CuSO4=3Cu+2Al2(SO4)3 |
下列关于浓H2SO4的叙述中,错误的是( )
| A、常温下可使某些金属钝化 |
| B、具有脱水性,故能作干燥剂 |
| C、加热条件下可与木炭反应,其氧化产物为CO2 |
| D、溶于水放出大量的热,稀释的时候应将浓硫酸缓缓加入水中并不断搅拌 |

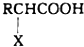 +HX
+HX Na2SO3因易被氧化成Na2SO4而变质,某化学兴趣小组为了测定实验室存放的Na2SO3的纯度(假设不含其它杂质),进行如下实验.
Na2SO3因易被氧化成Na2SO4而变质,某化学兴趣小组为了测定实验室存放的Na2SO3的纯度(假设不含其它杂质),进行如下实验.