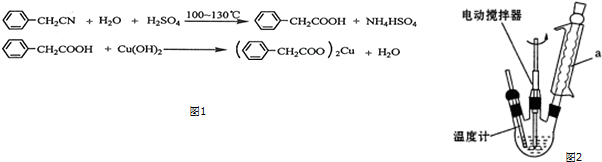
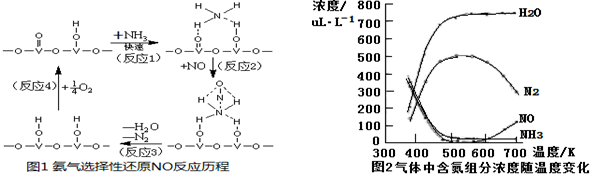
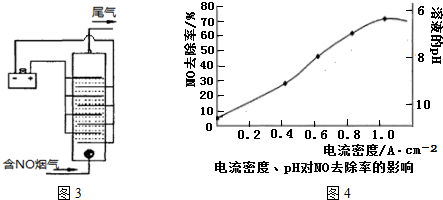
题目内容
19.在一密闭容器中(容积为2L),充入氨气5mol和氧气7.25mol,并发生如下反应:4NH3+5O2$?_{加热}^{催化剂}$4NO+6H2O(g),此反应在一定条件下进行2min后达到平衡,测得NH3的物质的量为4mol.(1)生成H2O(g)的物质的量为1.5mol,以NO的浓度变化表示该反应的平均反应速率是0.25mol/(L•min).
(2)O2的平衡浓度是3mol/L.
(3)NH3的转化率为20%.
(4)写出平衡常数的表达式K=$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$.
分析 2min后达到平衡,测得NH3的物质的量为4mol,则
4NH3+5O2$?_{加热}^{催化剂}$4NO+6H2O(g)
开始 5 7.25 0 0
转化 1 1.25 1 1.5
平衡 4 6 1 1.5
结合v=$\frac{△c}{△t}$、c=$\frac{n}{V}$、K为生成物浓度幂之积与反应物浓度幂之积的比.
解答 解:2min后达到平衡,测得NH3的物质的量为4mol,则
4NH3+5O2$?_{加热}^{催化剂}$4NO+6H2O(g)
开始 5 7.25 0 0
转化 1 1.25 1 1.5
平衡 4 6 1 1.5
(1)生成H2O(g)的物质的量为1.5mol,以NO的浓度变化表示该反应的平均反应速率是$\frac{\frac{1mol}{2L}}{2min}$=0.25mol/(L•min),
故答案为:1.5mol;0.25mol/(L•min);
(2)O2的平衡浓度是$\frac{6mol}{2L}$=3mol/L,
故答案为:3mol/L;
(3)NH3的转化率为$\frac{1mol}{5mol}$×100%=20%,
故答案为:20%;
(4)K为生成物浓度幂之积与反应物浓度幂之积的比,则K=$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$,故答案为:K=$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率和速率计算等为解答的关键,侧重分析与计算能力的考查,注意K的表达式及意义,题目难度不大.

| A. | 标准状况下,22.4 L水中含有6.02×1023个水分子 | |
| B. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| C. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L | |
| D. | 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L |
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
Ⅱ.研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
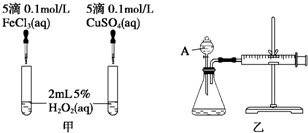
(4)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为分液漏斗,实验中需要测量的数据是收集40 mL气体所需要的时间.
| A. | 分子式为C2H4O2的有机物不一定有酸性 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2多 途径a:Al$\stackrel{HCl}{→}$H2 途径b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 |
2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
H2O(g)═H2O(l)△H=-Q3kJ/mol
(1)C2H2的燃烧热为Q1/2kJ/mol
(2)写出H2燃烧热的热化学方程式H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3)kJ/mol
(3)常温下,取体积比为4:1的C2H2和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为(2Q1+0.5Q2+Q3)kJ
(4)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2、H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3(OH)(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 反应在t1min末的速率为v(H2)=0.2/t mol•L-1•min-1 | |
| B. | 平衡时水蒸气的转化率为66.67% | |
| C. | 该温度下反应的平衡常数为l | |
| D. | 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时水蒸气的转化率为33.33% |
 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.