题目内容
17.下列关于有机化合物的说法正确的是( )| A. |  和 和 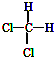 是两种种不同的物质 是两种种不同的物质 | |
| B. | 由乙烯之间的相互加成可以得到聚乙烯 | |
| C. | 丁烷与丁烯互为同系物 | |
| D. | 乙酸不能使紫色石蕊变红 |
分析 A.二氯甲烷没有同分异构体;
B.乙烯中碳碳双键其中一个碳碳键断裂,自身发生加成反应生成高聚物聚乙烯;
C.结构相似,组成上相差一个或若干个CH2原子团的有机物互为同系物;
D.乙酸是弱酸,具有酸的通性.
解答 解:A.二氯甲烷中C原子连接的4个原子在空间是相邻的, 和
和  是同一物质,故A错误;
是同一物质,故A错误;
B.乙烯中碳碳双键其中一个碳碳键断裂,自身发生加成反应生成高聚物聚乙烯,故B正确;
C.结构相似,组成上相差一个或若干个CH2原子团的有机物互为同系物,丁烷与丁烯碳原子数相同,不是同系物,故C产物;
D.乙酸是弱酸,具有酸的通性,能使紫色石蕊变红,故D错误;
故选B.
点评 本题考查了有机物的结构和性质,题目难度不大,把握同分异构体、同系物的概念以及官能团与性质的关系为解答的关键.

练习册系列答案
相关题目
7.Ⅰ.验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
(1)写出上述实验中发生反应的化学方程式2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
Ⅱ.研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
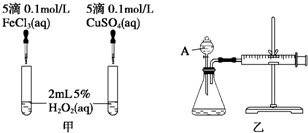
(4)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为分液漏斗,实验中需要测量的数据是收集40 mL气体所需要的时间.
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
Ⅱ.研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.

(4)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为分液漏斗,实验中需要测量的数据是收集40 mL气体所需要的时间.
8.已知:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-Q1kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
H2O(g)═H2O(l)△H=-Q3kJ/mol
(1)C2H2的燃烧热为Q1/2kJ/mol
(2)写出H2燃烧热的热化学方程式H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3)kJ/mol
(3)常温下,取体积比为4:1的C2H2和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为(2Q1+0.5Q2+Q3)kJ
(4)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2、H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3(OH)(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如下:
由此计算:△H1=kJ/mol.已知△H2=-58kJ/mol,则△H3=kJ/mol.
2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
H2O(g)═H2O(l)△H=-Q3kJ/mol
(1)C2H2的燃烧热为Q1/2kJ/mol
(2)写出H2燃烧热的热化学方程式H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3)kJ/mol
(3)常温下,取体积比为4:1的C2H2和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为(2Q1+0.5Q2+Q3)kJ
(4)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2、H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3(OH)(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
5.一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
①盐酸溶解Al2O3薄膜的离子方程式是6H++Al2O3=2Al3++3H2O.
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
a.浅棕色气体是NO2.
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
1Al+1NO3-+4H+═1Al3++1NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
为确认“刺激性气味”气体,进行如下实验:用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝.
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
| 装置 | 现象 |
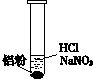 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
1Al+1NO3-+4H+═1Al3++1NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
| 装置 | 现象 |
 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
12.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称为:2,6-二甲基-5-乙基庚烷 的名称为:2,6-二甲基-5-乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 大气污染物氟利昂-12的化学式是CF2Cl2具有正四面体结构 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
9.一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)?CO2(g)+H2(g),部分数据见表(表中t2>t1),说法错误的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 反应在t1min末的速率为v(H2)=0.2/t mol•L-1•min-1 | |
| B. | 平衡时水蒸气的转化率为66.67% | |
| C. | 该温度下反应的平衡常数为l | |
| D. | 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时水蒸气的转化率为33.33% |
6.对于反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)的平衡常数K1,下列表述一定正确的是( )
| A. | K1=$\frac{[{H}_{2}]^{4}}{[{H}_{2}O]^{4}}$ | |
| B. | 增大c(H2O)或减小c(H2),会使平衡常数K1减小 | |
| C. | 改变反应的温度,平衡常数K1不一定变化 | |
| D. | Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g)的平衡常数为K2,K1×K2=1 |
7.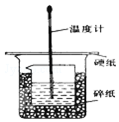 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中还缺少一个仪器,其名称是环形玻璃搅拌棒.在大小烧杯中填充泡沫塑料的作用是温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g•℃),则写出该反应的热化学方程式(离子方程式)H+(aq)+OH-(aq)=H2O(l)△H=-56.0kJ/mol (△H值保留到小数点后1位).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”).
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此
操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中还缺少一个仪器,其名称是环形玻璃搅拌棒.在大小烧杯中填充泡沫塑料的作用是温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
| 实验序号 | 起始温州 t1/℃ | 终止温度(t2)/℃[ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”).
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此
操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
