题目内容
8.常温下,将一元酸HA溶液和一元碱MOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:| 实验编号 | C(HA)mol•L-1 | c(MOH)/mol•L-1 | 混合溶液的pH |
| 甲 | pH=2 | pH=12 | pH<7 |
| 乙 | 0.1 | 0.1 | pH=a |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | a>7 | |
| B. | 在乙组混合液中c(OH-)-c(HA)=10-amol/L | |
| C. | c1<0.2 | |
| D. | 在丁组混合液中c(M+)>c(A-) |
分析 甲:将pH=2的HA和pH=12的MOH等体积混合时,混合溶液呈酸性,说明酸浓度大于碱浓度,酸有剩余,则HA电离程度小于MOH电离程度;
乙:将浓度都是0.1mol/L的HA、MOH等体积混合,二者恰好反应生成MA,如果HA、MOH都是弱电解质,则M+水解程度小于A-,如果MOH是强电解质,则HA是弱电解质,混合溶液呈碱性;
丙:HA的电离程度小于MOH,二者等体积混合,要使混合溶液呈中性,则酸应该稍微过量;
D.0.2mol/L的HA和0.1mol/L的MOH等体积混合,混合溶液中溶质为等物质的量浓度的MA、HA,混合溶液pH<7,说明混合溶液呈酸性,则HA电离程度大于A-水解程度.
解答 解:甲:将pH=2的HA和pH=12的MOH等体积混合时,混合溶液呈酸性,说明酸浓度大于碱浓度,酸有剩余,则HA电离程度小于MOH电离程度;
乙:将浓度都是0.1mol/L的HA、MOH等体积混合,二者恰好反应生成MA,如果HA、MOH都是弱电解质,则M+水解程度小于A-,如果MOH是强电解质,则HA是弱电解质,混合溶液呈碱性;
丙:HA的电离程度小于MOH,二者等体积混合,要使混合溶液呈中性,则酸应该稍微过量;
丁:0.2mol/L的HA和0.1mol/L的MOH等体积混合,混合溶液中溶质为等物质的量浓度的MA、HA,混合溶液pH<7,说明混合溶液呈酸性,则HA电离程度大于A-水解程度,
A.因为MOH电离程度大于HA,二者等体积等浓度混合,恰好反应生成MA,如果HA、MOH都是弱电解质,则M+水解程度小于A-,如果MOH是强电解质,则HA是弱电解质,混合溶液呈碱性,pH>7,所以a>7,故A正确;
B.如果MOH是强电解质、HA是弱电解质,根据电荷守恒得c(M+)+c(H+)=c(A-)+c(OH-),根据物料守恒得c(M+)=c(A-)+c(HA),所以得c(OH-)-c(HA)=c(H+)=10-amol/L,如果MOH、HA都是弱电解质,则存在c(M+)+c(H+)=c(A-)+c(OH-)、c(MOH)+c(M+)=c(A-)+c(HA),所以得c(OH-)-c(HA)=c(H+)-c(MOH)<c(H+)=10-amol/L,故B错误;
C.HA的电离程度小于MOH,二者等体积混合,要使混合溶液呈中性,则酸应该稍微过量,则c1>0.2,故C错误;
D.混合溶液pH<7,说明混合溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒知,存在c(M+)<c(A-),故D错误;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断能力,明确HA、MOH电离程度相对大小判断方法是解本题关键,易错选项是B,注意MOH是弱电解质情况,题目难度中等.

 名校课堂系列答案
名校课堂系列答案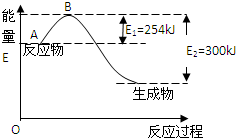 氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:
氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:(1)如图是氮气和氢气反应生成1mol氨气的能量变化示意图,写出上述反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol
(2)已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/( kJ/mol) | 435 | 943 |
(3)用氨催化还原NOx(氮氧化物),可消除污染.
已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ/mol
N2(g)+O2(g)═2NO(g)△H2=-b kJ/mol
则反应:4NH3(g)+6NO(g)═5N2(g)+6H2O(g) 的反应热△H=-(a+3b)kJ/mol (用含a和b的代数式表示)其中氧化剂是NO,还原剂是NH3(均填分子式)
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子与被还原的Cl原子的个数比为1:5 | |
| C. | 氧化剂与还原剂的物质的量的比为1:2 | |
| D. | 每生成1mol的NaClO3转移6mol的电子 |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 反应至6min时,c(H2O2)=0.20mol/L | |
| B. | 反应至6min时,H2O2分解了40% | |
| C. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| D. | 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) |
(1)推测此白色固体A所有可能的组成,将其化学式填入下表:
| 编 号 | ① | ② | ③ | ④ |
| 组成A的物质的化学式 |
 霞石是一种硅酸盐,其组成可表示为K2O•3Na2O•4Al2O3•8SiO2.某小组同学设计以霞石为原料制备Al2O3的方案如下:
霞石是一种硅酸盐,其组成可表示为K2O•3Na2O•4Al2O3•8SiO2.某小组同学设计以霞石为原料制备Al2O3的方案如下: