题目内容
16.可逆反应H2(g)+I2(g)?2HI(g)△H<0在某密闭容器内达到平衡,请回答下列问题①若缩小容器的体积,则气体的颜色变深(填“变深”、“变浅”或“不变”)
②若升高温度,则平衡逆向(填“正向”、“逆向”或“不”)移动.
分析 可逆反应H2(g)+I2(g)?2HI(g)△H<0在某密闭容器内达到平衡,反应是气体体积不变的放热反应,
①缩小容器体积,容器中压强增大,对平衡无影响,但体积缩小物质浓度增大;
②反应是放热反应,升温平衡向吸热反应方向进行,平衡逆向进行,碘单质浓度增大;
解答 解:可逆反应H2(g)+I2(g)?2HI(g)△H<0在某密闭容器内达到平衡,反应是气体体积不变的放热反应,依据化学平衡移动原理分析,
①反应前后气体体积不变,缩小容器体积,容器中压强增大,对化学平衡无影响,但体积缩小物质浓度增大,气体的颜色会变深,
故答案为:变深;
②反应是放热反应,若升温平衡向吸热反应方向进行,反应正反应是放热反应,所以平衡逆向进行,碘单质浓度增大,
故答案为:逆向.
点评 本题考查了外界条件对化学平衡的影响,注意该反应的反应前后气体体积不变,压强对其平衡无影响,为易错点,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.向一定量的铁和氧化亚铁,氧化铁,四氧化三铁的混合物中,加入150ml,4mol/L的稀硝酸,恰好使混合物完全溶解,并放出2.24LNO(标态),往得到溶液中加入KSCN 溶液,无红色出现.若用足量氢气在加热条件下还原相同质量的上述混合物,得到的铁的物质的量为( )
| A. | 0.21 mol | B. | 0.25 mol | C. | 0.3 mol | D. | 0.35mol |
7.下列物质中,属于电解质是( )
| A. | 铜丝 | B. | NaCl | C. | 酒精 | D. | 蔗糖 |
4.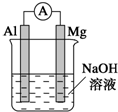 将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )
将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )
 将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )
将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 正极反应式为2H++2e-═H2↑ | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
8.常温下,将一元酸HA溶液和一元碱MOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
下列判断正确的是( )
| 实验编号 | C(HA)mol•L-1 | c(MOH)/mol•L-1 | 混合溶液的pH |
| 甲 | pH=2 | pH=12 | pH<7 |
| 乙 | 0.1 | 0.1 | pH=a |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | a>7 | |
| B. | 在乙组混合液中c(OH-)-c(HA)=10-amol/L | |
| C. | c1<0.2 | |
| D. | 在丁组混合液中c(M+)>c(A-) |
 室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示.
室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示.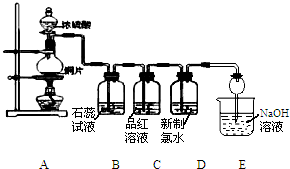 某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题:
某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题: