题目内容
13.对于反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O,以下叙述正确的是( )| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子与被还原的Cl原子的个数比为1:5 | |
| C. | 氧化剂与还原剂的物质的量的比为1:2 | |
| D. | 每生成1mol的NaClO3转移6mol的电子 |
分析 3Cl2+6NaOH═5NaCl+NaClO3+3H2O中,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,以此来解答.
解答 解:A.只有Cl元素的化合价变化,则氯气为氧化剂也为还原剂,故A错误;
B.由电子和原子守恒可知,5个Cl被还原与1个Cl被氧化时遵循电子守恒,则被氧化的Cl原子与被还原的Cl原子的个数比为1:5,故B正确;
C.氧化剂与还原剂均为氯气,物质的量的比为5:1,故C错误;
D.每生成1mol的NaClO3转移5mol的电子,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
4.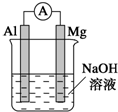 将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )
将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )
 将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )
将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 正极反应式为2H++2e-═H2↑ | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
8.常温下,将一元酸HA溶液和一元碱MOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
下列判断正确的是( )
| 实验编号 | C(HA)mol•L-1 | c(MOH)/mol•L-1 | 混合溶液的pH |
| 甲 | pH=2 | pH=12 | pH<7 |
| 乙 | 0.1 | 0.1 | pH=a |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | a>7 | |
| B. | 在乙组混合液中c(OH-)-c(HA)=10-amol/L | |
| C. | c1<0.2 | |
| D. | 在丁组混合液中c(M+)>c(A-) |
2.2016年1月4日襄阳市出现严重的雾霾天气,当天PM2.5指数出现爆表,教育主管部门紧急通知各中小学学校减少中小学生户外活动.其中的雾霾属于下列分散系中的( )
| A. | 溶液 | B. | 胶体 | C. | 悬浊液 | D. | 乳浊液 |
3.下列各组实验中溶液最先变浑浊的是( )
| A. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 10℃ | |
| B. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 10℃ | |
| C. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 30℃ | |
| D. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 30℃ |

 室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示.
室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示.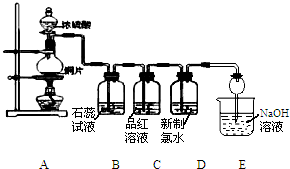 某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题:
某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题: