题目内容
6.I.碳和氮的化合物与人类生产、生活密切相关.(1)有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,
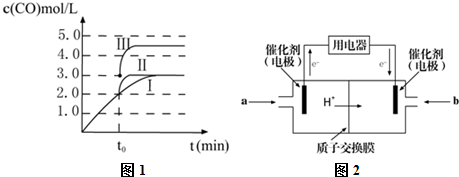
在反应过程中消除CO的理想做法是投入少量SO2,为搞清该方法对催化剂的影响,查阅资料并绘制图象如图1:
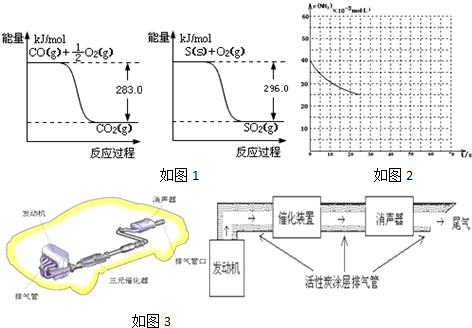
则:①不用通入O2氧化的方法除去CO的原因是避免O2与Ni反应再使其失去催化作用.
②SO2(g)+2CO(g)=S(s)+2CO2(g);△H=-270kJ/mol.
(2)汽车尾气中含大量CO和氮氧化物(NOx)等有毒气体.
①活性炭处理NO的反应:C(s)+2NO(g)?N2(g)+CO2 (g);△H=-a kJ•mol-1(a>0)若使NO更加有效的转化为无毒尾气排放,以下措施理论上可行的是b.
a.增加排气管长度 b.增大尾气排放口
c.添加合适的催化剂 d.升高排气管温度
②在排气管上添加三元催化转化装置如图3,CO能与氮氧化物(NOx)反应生成无毒尾气,其化学方程式是2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
Ⅱ.氮元素和碳元素一样也存在一系列氢化物并有广泛应用.例如:NH3、N2H4、N3H5、N4H6….
(1)写出该系列氢化物的通式NnHn+2(n≥2).
(2)已知NH3为一元碱,N2H4为二元碱,N2H4在水溶液中的一级电离方程式可表示为N2H4+H2O?N2H5++OH-,试写出N2H4的二级电离方程式N2H5++H2O?N2H62++OH-.
(3)已知用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g);△H<0
某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500.图2中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线.
分析 Ⅰ.(1)①Ni能与氧气反应也会导致其中毒,据此解答即可;
②利用盖斯定律进行计算即可;
(2)①依据此反应特点判断即可;
②根据反应物、生成物和反应条件及质量守恒定律的两个原则,写出正确的化学方程式;
Ⅱ.(1)根据氮原子和氢原子个数之间的关系确定氢化物的通式;
(2)N2H4是二元弱碱,可分别发生N2H4+H2O?N2H5++OH-、N2H5++H2O?N2H62++OH-两步电离;
(3)依据化学方程式和平衡常数概念写出表达式,注意尿素是固体;根据化学平衡三段式列式计算平衡浓度,计算平衡常数;依据催化剂的作用画出图象.
解答 解:Ⅰ.(1)①Ni能与氧气反应也会导致其中毒,故答案为:避免O2与Ni反应再使其失去催化作用;
②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
(i)-(ii)得:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-563-(-298)=-270kJ•mol-1,故答案为:-270kJ/mol;
(2)①C(s)+2NO(g)?N2(g)+CO2 (g)△H=-a kJ•mol-1,此反应为放热反应,且为气体体积不变的反应,a.增加排气管长度,不能改变NO的转化率,故a错误;
b.增大尾气排放口,相当于移出部分氮气和二氧化碳气体,利于平衡右移,故b正确;
c.添加合适的催化剂,只改变化学反应速率,不会增加NO的转化率,故c错误;
d.升高排气管温度,温度升高,平衡左移,不利于NO转化,故d错误;故选b;
②反应物是一氧化碳和NOx,生成物无毒,故生成物之一是氮气和二氧化碳,根据反应前后元素种类不变,化学方程式为:2xCO+2NOx $\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2,
故答案为:2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2;
Ⅱ.(1)根据氮原子和氢原子个数之间的关系:氢原子个数比氮原子个数多2,所以通式表示为:NnHn+2(n≥2),故答案为:NnHn+2(n≥2);
(2)N2H4是二元弱碱,可分别发生N2H4+H2O?N2H5++OH-、N2H5++H2O?N2H62++OH-,故答案为:N2H5++H2O?N2H62++OH-;
(3)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g).依据化学方程式和平衡常数概念写出平衡常数K=$\frac{c({H}_{2}O)}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,反应达到平衡时CO2的转化率为50%,消耗二氧化碳浓度0.02mol/L×50%=0.01mol/mol;
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol/L) 0.04 0.02 0 0
变化量(mol/L) 0.02 0.01 0 0.01
平衡量(mol/L) 0.02 0.01 0 0.01
K=$\frac{c({H}_{2}O)}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$=$\frac{0.01}{0.02{\\;}^{2}×0.01}$=2500L2•mol-2
如图2中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其它条件不变情况下,在图中用实线画出使用催化剂时,改变反应速率,不改变化学平衡,该反应的进程曲线为,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,如图为 ,
,
故答案为:2500; .
.
点评 本题考查了热化学方程式书写方法,化学平衡影响因素分析,弱电解质的电离等综合知识的考查,掌握基础是关键,题目难度中等.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 >HCO3-,则下列化学方程式错误的是( )
>HCO3-,则下列化学方程式错误的是( )| A. | 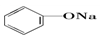 +HCl→ +HCl→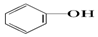 +NaCl +NaCl | B. | 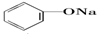 +H2O+CO2→ +H2O+CO2→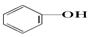 +NaHCO3 +NaHCO3 | ||
| C. | 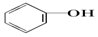 +Na2CO3→ +Na2CO3→ +NaHCO3 +NaHCO3 | D. |  +NaHCO3→ +NaHCO3→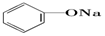 +H2CO3 +H2CO3 |
| A. | X:2s22p1 Y:2s22p4 | B. | X:3s23p1 Y:3s23p5 | ||
| C. | X:3s23p2 Y:2s22p3 | D. | X:3s2 Y:2s22p3 |
| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |
(2)图1表示在密闭体系中进行实验,测定不同温度下,在相同时间内各组分的浓度.

①图中a、b、c三点,主反应速率最大的是c.
②试解释N2浓度曲线先上升后下降的原因先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓 度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动,且随温度升高有副产物的生成,N2浓度降低.
③550K时,欲提高N2O的百分含量,应采取的措施是采用合适的催化剂.
(3)为探究碳基催化剂中Fe、Mn、Ni等元素的回收,将该催化剂溶解后得到含有Fe2+、Mn2+、Ni2+的溶液,物质的量浓度均为10-3mol•L-1.欲完全沉淀Fe2+、Mn2+(离子浓度低于1.0×10-6),应控制CO32-的物质的量浓度范围为(3.0×10-5,1.0×10-4 ).
| 沉淀物 | Ksp |
| FeCO3 | 3.0×10-11 |
| MnCO3 | 2.0×10-11 |
| NiCO3 | 1.0×10-7 |
a为外接电源的负极(填“正”、“负”).通入NO的电极反应式为2NO+4e-=N2+2O2-.