题目内容
20.已知几种物质的酸性强弱顺序为HCl>H2CO3> >HCO3-,则下列化学方程式错误的是( )
>HCO3-,则下列化学方程式错误的是( )| A. | 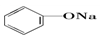 +HCl→ +HCl→ +NaCl +NaCl | B. |  +H2O+CO2→ +H2O+CO2→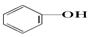 +NaHCO3 +NaHCO3 | ||
| C. | 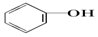 +Na2CO3→ +Na2CO3→ +NaHCO3 +NaHCO3 | D. |  +NaHCO3→ +NaHCO3→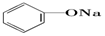 +H2CO3 +H2CO3 |
分析 酸性强弱顺序为HCl>H2CO3> >HCO3-,可发生强酸制取弱酸的反应,以此来解答.
>HCO3-,可发生强酸制取弱酸的反应,以此来解答.
解答 解:A.HCl的酸性大于苯酚的酸性,则可发生 +HCl→
+HCl→ +NaCl,故A正确;
+NaCl,故A正确;
B.酸性H2CO3> ,则可发生
,则可发生 +H2O+CO2→
+H2O+CO2→ +NaHCO3,故B正确;
+NaHCO3,故B正确;
C.酸性 >HCO3-,则可发生
>HCO3-,则可发生 +Na2CO3→
+Na2CO3→ +NaHCO3,故C正确;
+NaHCO3,故C正确;
D.酸性H2CO3> ,
, +NaHCO3→
+NaHCO3→ +H2CO3不能发生,故D错误;
+H2CO3不能发生,故D错误;
故选D.
点评 本题考查有机物的性质及化学反应,为高频考点,把握强酸制取弱酸的反应原理为解答的关键,侧重分析与应用能力的考查,注意苯酚的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.在可逆反应中,平衡常数与反应进行的限度关系正确的是( )
| A. | K越大,反应程度越大 | B. | K越大,反应程度越小 | ||
| C. | K的大小与反应程度无关 | D. | 升高温度,K增大 |
8.下列说法中,不正确的是( )
| A. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 | |
| B. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
12.硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见表.
请回答下列问题:
(1)红棕色滤渣的主要成分是Fe(OH)3;
(2)写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)操作I的操作温度应该控制在100℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为冷却结晶、过滤 洗涤、干燥;
(5)反应产物中的NO可以循环使用,试仅用一个化学方程式表示NO转化为HNO3:4NO+3O2+H2O=4HNO3.

胆矾和石膏在不同温度下的溶解度(g/100g水)见表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是Fe(OH)3;
(2)写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)操作I的操作温度应该控制在100℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为冷却结晶、过滤 洗涤、干燥;
(5)反应产物中的NO可以循环使用,试仅用一个化学方程式表示NO转化为HNO3:4NO+3O2+H2O=4HNO3.
9.在酸性或碱性条件下,溶液中都能大量共存的离子组是( )
| A. | Na+、K+、SO42-、CO32- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Mg2+、K+、HCO3-、Cl- |
 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: