题目内容
18.X、Y两种元素可形成X2Y3型化合物,则X和Y原子最外层的电子排布可能是( )| A. | X:2s22p1 Y:2s22p4 | B. | X:3s23p1 Y:3s23p5 | ||
| C. | X:3s23p2 Y:2s22p3 | D. | X:3s2 Y:2s22p3 |
分析 X、Y两种元素可形成X2Y3型化合物,则X为+3价,Y为-2价,即X的价电子数为3,Y的价电子数为6,并结合电子排布判断元素来解答.
解答 解:A.X为B,Y为O,可形成X2Y3型化合物,化合物为B2O3,故A选;
B.X为P,Y为Cl,不能形成X2Y3型化合物,故B不选;
C.X为Si,Y为N,不能形成X2Y3型化合物,故C不选;
D.X为Mg,Y为N,不能形成X2Y3型化合物,故D不选;
故选A.
点评 本题考查原子结构与元素的性质,为高频考点,把握电子排布、价电子判断元素为解答的关键,侧重分析与应用能力的考查,注意常见物质的构成,题目难度不大.

练习册系列答案
相关题目
8.下列说法中,不正确的是( )
| A. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 | |
| B. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
9.在酸性或碱性条件下,溶液中都能大量共存的离子组是( )
| A. | Na+、K+、SO42-、CO32- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Mg2+、K+、HCO3-、Cl- |
13.下列物质中不属于离子晶体的是( )
| A. | 氯化铵 | B. | 硫酸 | C. | 食盐 | D. | 氧化钠 |
3.用下列方法均可制得氧气:
(1)2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑
(2)2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
(3)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
(1)2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑
(2)2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
(3)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
| A. | 3:1:4 | B. | 2:1:1 | C. | 1:1:1 | D. | 1:2:2 |
3. 2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0.在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是CD.
A.在单位时间内生成1mol CO2的同时消耗了lmol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
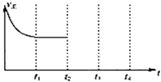
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速随时间的变化曲线:
③若要同时提高该反应的速率和NO的转化率,采取的措施有增大压强、增大CO浓度.(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应C(g)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1
①该反应在高温下能自发进行(填“高温”或“低温”).
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-.[已知:Ka1(H2S)=9.1×10-8,Ka2(H2S)=1.1×10-12;Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11]
(3)已知反应:CO(g)+H2O(g)?CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①实验1条件下平衡常数K=2.67(保留小数点后二位).
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b.
③该反应的△H>0 (填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO、5mo1H2O、2mo1CO2、5mol H2,则此时v(正)<v(逆)(填“<”、“>”或“=”).
 2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0.在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是CD.
A.在单位时间内生成1mol CO2的同时消耗了lmol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速随时间的变化曲线:
③若要同时提高该反应的速率和NO的转化率,采取的措施有增大压强、增大CO浓度.(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应C(g)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1
①该反应在高温下能自发进行(填“高温”或“低温”).
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-.[已知:Ka1(H2S)=9.1×10-8,Ka2(H2S)=1.1×10-12;Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11]
(3)已知反应:CO(g)+H2O(g)?CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b.
③该反应的△H>0 (填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO、5mo1H2O、2mo1CO2、5mol H2,则此时v(正)<v(逆)(填“<”、“>”或“=”).

