题目内容
3.已知:二元酸H2R 的电离方程式是:H2R=H++HR-,HR-?R2-+H+,若0.1mol•L-1NaHR溶液的c(H+)=a mol•L-1,则0.1mol•L-1H2R溶液中c(H+)是( )| A. | 小于 (0.1+a) mol•L-1 | B. | 大于 (0.1+a) mol•L-1 | ||
| C. | 等于 (0.1+a) mol•L-1 | D. | 等于2a mol•L-1 |
分析 根据电离方程式知,HR-只电离不水解,0.1mol•L-1NaHR溶液的c(H+)=a mol•L-1,则HR-电离出氢离子浓度为amol/L,H2A第一步电离出的氢离子抑制第二步电离,由此分析解答.
解答 解:根据电离方程式知,HR-只电离不水解,0.1mol•L-1NaHR溶液的c(H+)=a mol•L-1,则HR-电离出氢离子浓度为amol/L,H2A第一步电离出的氢离子抑制第二步电离,0.1mol•L-1H2R溶液中c(H+)小于 (0.1+a) mol•L-1,故选:A.
点评 本题考查弱电解质的电离,注意题干信息中H2A的两步电离不同,第一步完全电离、第二步部分电离,导致HA-只电离不水解,为易错题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列溶液中各组离子一定能够大量共存的是( )
| A. | 含有Fe3+的溶液:Na+、K+、SCN-、NO3- | |
| B. | 能使pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、CO32-、OH- | |
| D. | 能使淀粉KI试纸显蓝色的溶液:K+、SO42-、Fe2+、NH4+ |
14.随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了延长食品的保质期,防止食品受潮变质,在包装袋中可以放入的化学物质是( )
| A. | 硅胶 | B. | 硫酸亚铁 | C. | 食盐 | D. | 石灰石 |
11.下列说法正确的是( )
| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
18.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 在12 g单层石墨中,含六元环的数目为1NA | |
| B. | 50mL 18.4mol•L-1浓硫酸与足量铜加热充分反应,生成SO2分子的数目为0.46 NA | |
| C. | 42 g由乙烯和环丙烷组成的混合气体中,碳氢键的数目为6NA | |
| D. | 1mol过氧化钠与足量CO2充分反应,转移的电子数为2NA |
15.1mol•L-1的稀醋酸中存在平衡:CH3COOH?CH3COO-+H+.下列说法正确的是( )
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1盐酸,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
 某学生在如图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题:
某学生在如图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题: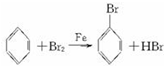 .
.