题目内容
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
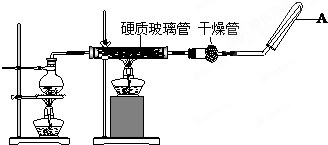
(1)写出该反应的反应方程式 ;
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,其作用是 .
(3)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 .

(1)写出该反应的反应方程式
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是
(3)试管中收集气体是
考点:实验装置综合,铁及其化合物的性质实验
专题:实验题
分析:铁与水蒸气发生氧化还原反应生成Fe3O4和H2,实验时,圆底烧瓶中盛装的水,加热可提供水蒸气,水蒸气在硬质管中与铁粉反应生成氢气,A用于收集氢气,点燃氢气时,应先验纯,防止爆炸,以此解答该题.
解答:
解:(1)铁与水蒸气发生氧化还原反应生成Fe3O4和H2,方程式为3Fe+4H2O(g)
Fe3O4+4H2,
故答案为:3Fe+4H2O(g)
Fe3O4+4H2;
(2)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,烧瓶底部应事先放置碎瓷片,放碎瓷片的目的是防止沸腾事故发生,
故答案为:提供反应的水蒸气; 防止爆沸;
(3)水蒸气在硬质管中与铁粉反应生成氢气,A用于收集氢气,氢气的爆炸极限是4.0%~75.6%,就是说当氢气的含量在上述范围内的话就会引起爆炸,因此,点燃之前要检验纯度.故答案为:H2;验纯.
| ||
故答案为:3Fe+4H2O(g)
| ||
(2)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,烧瓶底部应事先放置碎瓷片,放碎瓷片的目的是防止沸腾事故发生,
故答案为:提供反应的水蒸气; 防止爆沸;
(3)水蒸气在硬质管中与铁粉反应生成氢气,A用于收集氢气,氢气的爆炸极限是4.0%~75.6%,就是说当氢气的含量在上述范围内的话就会引起爆炸,因此,点燃之前要检验纯度.故答案为:H2;验纯.
点评:本题考查性质实验方案的设计,为高频考点,把握高温下铁与水反应及实验中装置的作用为解答的关键,侧重物质性质及实验分析能力的考查,题目难度中等.

练习册系列答案
相关题目
一包由常见盐混合组成的白色粉末,其中只可能含Na+、K+、Al3+、CO32-、HCO3-、SO42-、SO32-、NO2-中的若干种离子.某同学对该粉末进行如下实验:

说法正确的是( )

说法正确的是( )
| A、白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B、原混合物一定含有Na+、Al3+、NO2- |
| C、白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D、气体乙一定是NO和NO2的混合气体 |
碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是( )
| A、反应物分子必须碰撞才有可能发生反应 |
| B、发生有效碰撞的分子具有最高的能量 |
| C、有效碰撞是活化分子在一定方向上的碰撞 |
| D、活化分子的平均能量称之活化能 |
合成氨工业对国民经济和社会发展具有重要的意义.哈伯法合成氨需要在20~50MPa的高压和500℃左右的高温下,并用铁触媒作为催化剂,氨在平衡混合物中的含量仍较少.最近英国俄勒冈大学的化学家使用了一种名为 trans一Fe(DMeOPrPE)2的新催化剂,在常温下合成氨,反应方程式可表示为N2+3H2?2NH3.有关说法正确的是( )
| A、哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B、新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景 |
| C、新法合成氨能在常温下进行是因为不需要断裂化学键 |
| D、新催化剂降低了反应所需要的能量,使平衡正向移动 |
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+H+下列说法正确的是( )
| A、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| B、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| C、在H2O2分解过程中,溶液的pH逐渐下降 |
| D、H2O2生产过程中加入少量Fe2+可以提高产率 |
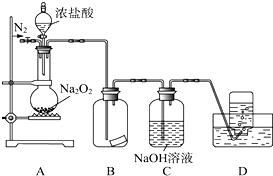 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下:
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下: Na2O2+
Na2O2+