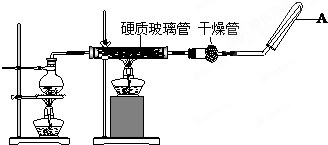
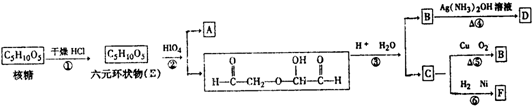
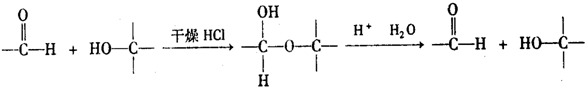
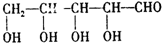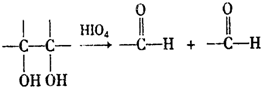题目内容
合成氨工业对国民经济和社会发展具有重要的意义.哈伯法合成氨需要在20~50MPa的高压和500℃左右的高温下,并用铁触媒作为催化剂,氨在平衡混合物中的含量仍较少.最近英国俄勒冈大学的化学家使用了一种名为 trans一Fe(DMeOPrPE)2的新催化剂,在常温下合成氨,反应方程式可表示为N2+3H2?2NH3.有关说法正确的是( )
| A、哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B、新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景 |
| C、新法合成氨能在常温下进行是因为不需要断裂化学键 |
| D、新催化剂降低了反应所需要的能量,使平衡正向移动 |
考点:工业合成氨
专题:化学平衡专题
分析:A、合成氨都是放热反应,催化剂不会改变反应热;
B、根据题目给出信息“在常温下合成氨”来回答;
C、化学反应都涉及旧键的断裂和新键的生成;
D、催化剂降低反应所需要能量,但是不改变平衡的移动.
B、根据题目给出信息“在常温下合成氨”来回答;
C、化学反应都涉及旧键的断裂和新键的生成;
D、催化剂降低反应所需要能量,但是不改变平衡的移动.
解答:
解:A、哈伯法合成氨和新法合成氨都是放热反应,使用催化剂不会改变反应热,故A错误;
B、题目给出信息“在常温下合成氨”,所以不需要在高温条件下,可节约大量能源,具有发展前景,故B正确;
C、任何化学反应都涉及旧键的断裂和新键的生成,故C错误;
D、新催化剂降低了反应所需要的能量,但是不改变平衡的移动,故D错误.
故选B.
B、题目给出信息“在常温下合成氨”,所以不需要在高温条件下,可节约大量能源,具有发展前景,故B正确;
C、任何化学反应都涉及旧键的断裂和新键的生成,故C错误;
D、新催化剂降低了反应所需要的能量,但是不改变平衡的移动,故D错误.
故选B.
点评:本题涉及催化剂的特点以及化学平衡移动原理知识,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
检验试样中有无某离子的操作及结论不合理的是( )
| A、先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则溶液中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则待测液中一定含有钾元素 |
下列离子方程式不正确的是( )
| A、敞开体系,向FeCl2溶液滴加NaOH:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓ |
| B、酸性 FeSO4 溶液中加 H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
| C、硫代硫酸钠溶液中加入稀硫酸:2H++S2O3-=S↓+SO2↑+H2O |
| D、将氧气通入酸性碘化钾溶液中:2I-+O2+4H+=I2+2H2O |
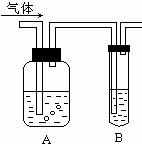 如图把气体缓慢通过盛有足量试剂的试剂瓶A,试管B不能观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,试管B不能观察到明显现象的是( )