题目内容
3.下列离子方程式中,错误的是( )| A. | 氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| C. | 二氧化硅与强碱反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 二氧化氮与水反应:3NO2+H2O═2H++2NO3-+NO |
分析 A.烧碱为氢氧化钠,氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水;
B.铜的活泼性较弱,不与稀硫酸反应;
C.二氧化硅与氢氧根离子反应生成硅酸根离子和水;
D.二氧化氮与水反应生成硝酸和NO气体.
解答 解:A.氯气与烧碱溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故A正确;
B.Cu不与稀硫酸反应,无法书写离子方程式,故B错误;
C.二氧化硅与强碱反应生成硅酸盐和水,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,故C正确;
D.二氧化氮与水反应生成硝酸和一氧化氮,反应的离子方程式为:3NO2+H2O═2H++2NO3-+NO,故D正确;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
13.某温度下,0.01mol/L NaOH的pH为10,该温度下将pH=5的强酸溶液和pH=8的强碱溶液混合后pH=7,则酸溶液体积和碱溶液体积比为( )
| A. | 1:10 | B. | 10:1 | C. | 9:2 | D. | 2:9 |
14.铁的合金是当今世界使用量最大的合金,下列关于铁及其化合物的说法正确的是( )
| A. | 铁的氧化物都具有磁性 | |
| B. | 氢氧化亚铁在空气中加热会分解生成氧化亚铁和水蒸气 | |
| C. | 铁在空气中放置表面会生成致密的氧化膜从而阻止铁被继续腐蚀 | |
| D. | 四氧化三铁可以通过置换反应或化合反应制备 |
11.下列叙述及评价均合理的是( )
| 选项 | 叙述 | 评价 |
| A | 含18O的乙醇和乙酸反应制备乙酸乙酯则反应后18O存在于任何物质中 | 对,因为此反应为可逆反应 |
| B | 往苯酚钠溶液中通入CO2,可制备得到苯酚,并得到碳酸氢钠 | 对,根据强酸制弱酸的规律,碳酸的酸性比苯酚的酸性强,故可用此反应制备苯酚 |
| C | 向卤代烃水解后的溶液中直接加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀 |
| D | 用酸性高锰酸钾溶液除去甲烷中的乙烯气体 | 对,乙烯能与酸性高锰酸钾溶液反应,而甲烷不能与高锰酸钾溶液反应. |
| A. | A | B. | B | C. | C | D. | D |
18.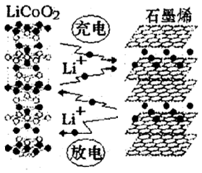 2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
 2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )| A. | 该电池若用隔膜可选用质子交换膜 | |
| B. | 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-═Li1-xCoO2+xLi+ | |
| C. | 石墨烯电池的优点是提高电池的储铿容量进而提高能量密度 | |
| D. | 废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收 |
8.下列各反应中,能说明浓H2SO4既有氧化性又有酸性的是( )
| A. | S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O | |
| B. | NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑ | |
| C. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O | |
| D. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O |
15.下列反应的离子方程式书写不正确的是( )
| A. | 稀硫酸与氢氧化钾溶液反应:H++OH-═H2O | |
| B. | 过氧化钠与水反应:2Na2O 2+2H2O═4Na++4OH-+O2↑ | |
| C. | 氧化铁溶于盐酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na与硫酸铜溶液反应:2Na+Cu2+═2Na++Cu |
12.下列反应中既属于分解反应又属于氧化还原反应的是( )
| A. | Fe+2HCl═FeCl2+H2 | B. | CH4$\frac{\underline{\;高温\;}}{\;}$C+2H2 | ||
| C. | Mg(OH)2+2HCl═MgCl2+2H2O | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2 |
 的名称是2,4-二甲基戊烷,对二甲苯的结构简式是
的名称是2,4-二甲基戊烷,对二甲苯的结构简式是