题目内容
15.下列反应的离子方程式书写不正确的是( )| A. | 稀硫酸与氢氧化钾溶液反应:H++OH-═H2O | |
| B. | 过氧化钠与水反应:2Na2O 2+2H2O═4Na++4OH-+O2↑ | |
| C. | 氧化铁溶于盐酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na与硫酸铜溶液反应:2Na+Cu2+═2Na++Cu |
分析 A.稀硫酸与氢氧化钾溶液反应生成硫酸钾和水;
B.过氧化钠与水反应生成氢氧化钠和氧气;
C.氧化铁为三氧化二铁,氧化铁与盐酸反应生成氯化铁和水;
D.钠与硫酸铜溶液反应不能置换出金属铜.
解答 解:A.稀硫酸与氢氧化钾溶液反应的离子方程式为:H++OH-═H2O,故A正确;
B.过氧化钠与水反应的离子方程式为:2Na2O 2+2H2O═4Na++4OH-+O2↑,故B正确;
C.氧化铁溶于盐酸,氧化铁不能拆开,反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O,故C正确;
D.钠与硫酸铜溶液反应生成氢气、硫酸钠和氢氧化铜沉淀,正确的离子方程式为:2Na+2H2O+Cu2+═H2↑+2Na++Cu(OH)2↓,故D错误;
故选D.
点评 本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
5.短周期元素A和B形成的化合物AB2有多种可能,对这些可能的化合物的判断正确的是( )
| A. | 化合物AB2不可能是离子化合物 | |
| B. | 化合物AB2的晶体可能是分子晶体、离子晶体或原子晶体 | |
| C. | 化合物AB2的熔点不可能很高 | |
| D. | 化合物AB2的空间立体结构不可能是V形结构 |
6.氢化亚铜(CuH)是一种难溶物质,具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+═Cu2++Cu.根据以上信息,下列叙述正确的是( )
| A. | 用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作氧化剂 | |
| B. | CuH在氯气中燃烧的化学反应方程式为2CuH+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl | |
| C. | CuH溶解在稀盐酸中生成的气体是氯气 | |
| D. | 如果选项C反应中生成了标准状况下22.4 L的气体,则转移电子3 mol |
3.下列离子方程式中,错误的是( )
| A. | 氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| C. | 二氧化硅与强碱反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 二氧化氮与水反应:3NO2+H2O═2H++2NO3-+NO |
10.下列物质由分子构成且属于电解质的是( )
| A. | H2SO4 | B. | C60 | C. | NH3 | D. | Fe |
4.下列装置或操作正确并能达到实验目的( )


| A. | 用Ⅰ图装置,可得到干燥的CO2 | |
| B. | 用Ⅱ图装置,若C中出现白色沉淀,则可说明H2CO3的酸性强于H2SiO3 | |
| C. | 用Ⅲ图装置,可除去氯化钠溶液中的泥沙 | |
| D. | 用Ⅳ图装置,分离乙醇和水 |
 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.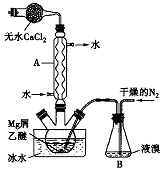 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下: