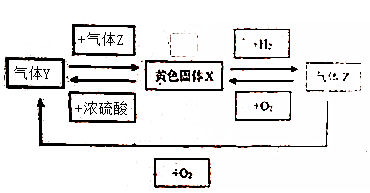
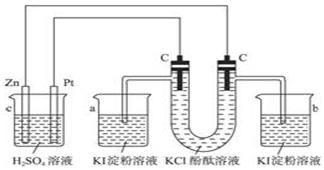
题目内容
13.某温度下,0.01mol/L NaOH的pH为10,该温度下将pH=5的强酸溶液和pH=8的强碱溶液混合后pH=7,则酸溶液体积和碱溶液体积比为( )| A. | 1:10 | B. | 10:1 | C. | 9:2 | D. | 2:9 |
分析 某温度时0.01mol•L-1的NaOH溶液的pH为10,则KW=0.01×10-10=1.0×10-12,该温度下pH=5的溶液中氢离子浓度为1.0×10-5mol/L,pH=8的强碱溶液中氢氧根离子浓度为:$\frac{1×1{0}^{-12}}{1×1{0}^{-8}}$mol/L=1.0×10-4mol/L,pH=7时氢氧根离子浓度为$\frac{1×1{{0}^{-}}^{12}}{1×1{0}^{-7}}$mol/L=1.0×10-5mol/L,设出两溶液体积,溶液列式计算出两溶液体积之比.
解答 解:某温度时0.01mol•L-1的NaOH溶液的pH为10,则KW=0.01×10-10=1.0×10-12,该温度下pH=5的强酸溶液中氢离子浓度为1.0×10-5mol/L,pH=8的强碱溶液中氢氧根离子浓度为:$\frac{1×1{0}^{-12}}{1×1{0}^{-8}}$mol/L=1.0×10-4mol/L,pH=7时氢氧根离子浓度为$\frac{1×1{{0}^{-}}^{12}}{1×1{0}^{-7}}$mol/L=1.0×10-5mol/L,
设强酸溶液体积为x,强碱溶液体积为y,反应后溶液呈碱性,则:$\frac{1×1{0}^{-4}y-1×1{0}^{-5}x}{x+y}$=1.0×10-5,整理可得x:y=9:2,
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,正确计算该稳定性水的离子积为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
10.下列说法中正确的是( )
| A. | 将苯加入溴水中振荡后,水层接近无色,是因为发生了取代反应 | |
| B. | 一体积某气态烃与HC1充分加成消耗HC1一体积,加成后的物质最多还能和5体积氯气发生取代反应,由此推断原气态烃是乙烯 | |
| C. | 环己醇能与氢氧化钠溶液反应且所有碳原子可以共面 | |
| D. | 等质量的乙烯和乙醇在氧气中充分燃烧后耗氧量相同. |
18.下列说法中正确的是( )
| A. | pH=2的盐酸溶液稀释100倍,pH=0 | |
| B. | pH=12的氢氧化钠溶液稀释10倍,pH=13 | |
| C. | pH=5的硫酸溶液稀释1000倍,pH=8 | |
| D. | pH=3的盐酸溶液稀释10倍,pH=4 |
5.短周期元素A和B形成的化合物AB2有多种可能,对这些可能的化合物的判断正确的是( )
| A. | 化合物AB2不可能是离子化合物 | |
| B. | 化合物AB2的晶体可能是分子晶体、离子晶体或原子晶体 | |
| C. | 化合物AB2的熔点不可能很高 | |
| D. | 化合物AB2的空间立体结构不可能是V形结构 |
2.下列说法正确的是( )
| A. | 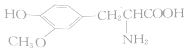 与 与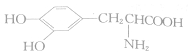 互为同系物 互为同系物 | |
| B. | CH3CH=CHCH3分子中所有原子在同一平面上 | |
| C. | 按系统命名法,化合物 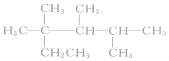 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | 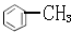 的一溴代物和 的一溴代物和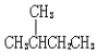 的一溴代物都有4种(不考虑立体结构) 的一溴代物都有4种(不考虑立体结构) |
3.下列离子方程式中,错误的是( )
| A. | 氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| C. | 二氧化硅与强碱反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 二氧化氮与水反应:3NO2+H2O═2H++2NO3-+NO |