题目内容
6.向一定量的Fe、FeO和Fe2O3的混合物中加入100ml 2mol/L的盐酸,恰好使混合物完全溶解,放出44.8ml标准状况下的气体,所得溶液中,加入溶液无红色出现,那么若用一氧化碳在高温下还原相同质量的此混合物,能得到铁的质量( )| A. | 5.6g | B. | 2.8 g | C. | 11.2g | D. | 无法计算 |
分析 盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl);用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2),据此结合m=nM计算得到的铁的质量.
解答 解:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.1L×2mol/L=0.1mol;
用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.1mol,质量为0.1mol×56g/mol=5.6g,
故选A.
点评 本题考查混合物的计算,难度中等,气体体积为干扰数据,利用元素守恒判断铁的物质的量是解题关键,注意守恒思想的运用.

练习册系列答案
相关题目
17.某无色气体可能含有CO、H2、O2、CO2、NH3、NO、HCl、NO2、SO2等气体中的若干种,为确定其成分,某学生进行了如下实验:
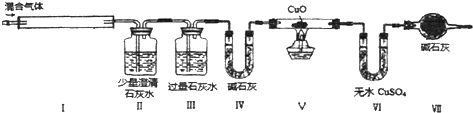
①将混合气体导入品红溶液中,红色没有变化.
②将混合气体导入如图装置中,I中有红棕色出现;Ⅱ未见明显现象;Ⅲ溶液中出现白色浑浊;V中CuO变为红色;Ⅵ中CuSO4出现蓝色.
下列判断正确的是( )

①将混合气体导入品红溶液中,红色没有变化.
②将混合气体导入如图装置中,I中有红棕色出现;Ⅱ未见明显现象;Ⅲ溶液中出现白色浑浊;V中CuO变为红色;Ⅵ中CuSO4出现蓝色.
下列判断正确的是( )
| A. | 混合气体中一定有NO2和CO | |
| B. | 混合气体中一定没有H2和NH3 | |
| C. | 混合气体中一定含有H2、NO、CO2、HCl四种气体 | |
| D. | 不能确定混合气体中是否有NH3 |
1.在含有0.078molFeCl2溶液中通入0.009molCl2,再加入含有0.01molX2O72-的酸性溶液,使溶液中的Fe2+恰好全部氧化,并使X2O72-还原成xn+离子,n值为( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
11.加热蒸干下列盐溶液,可得到原溶质的是( )
| A. | FeCl3 | B. | Na2CO3 | C. | K2SO3 | D. | TiCl4 |
18.“轨道”2Px与3Py上电子一定相同的方面是( )
| A. | 能量 | B. | 呈纺锤形 | ||
| C. | 自旋方向 | D. | 在空间的伸展方向 |
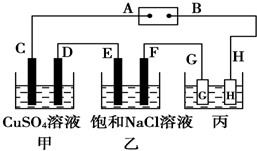 如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题: