题目内容
有A、B、C、D、E五种主族元素,A原子中质子和中子数相等,A元素在其最高价氧化物中含量为40%,在其氢化物中含量为94.1%,B是同周期中除稀有元素外原子半径最大的元素,C和D的原子序数分别比E和A的原子序数大1,C和D能形成CD3的化合物,B和D的离子具有相同的电子层结构,18g C和足量的稀H2SO4反应生成的H2在标准状况下的体积为22.4L,C原子中有14个中子.试回答下列问题:
(1)B的名称 . E离子的结构示意图 .
(2)用电子式表示ED2的形成过程 .
(3)A、C、D离子半径由小到大的顺序为 (用离子符号表示).
(4)C和E与B的最高价氧化物的水化物构成原电池,负极的电极方程式 .
(5)某温度下,在0.20L的0.002mol?L-1 ESO4溶液中加入等体积的0.10mol?L-1的氨水溶液,试通过计算,溶液中有无E(OH)2沉淀.(该温度下ksp[E(OH)2]=2×10-11,电离常数Kb(NH3?H2O)=2×10-5)(列出简单的计算过程)
(1)B的名称
(2)用电子式表示ED2的形成过程
(3)A、C、D离子半径由小到大的顺序为
(4)C和E与B的最高价氧化物的水化物构成原电池,负极的电极方程式
(5)某温度下,在0.20L的0.002mol?L-1 ESO4溶液中加入等体积的0.10mol?L-1的氨水溶液,试通过计算,溶液中有无E(OH)2沉淀.(该温度下ksp[E(OH)2]=2×10-11,电离常数Kb(NH3?H2O)=2×10-5)(列出简单的计算过程)
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:令A元素最高正化合价为a,则最低负化合价为(a-8),A的相对分子质量为b,
A元素最高价氧化物中A原子与O原子数目之比为2:a,由A元素在其最高价氧化物中的含量是40%,则2b:16a=40%:(1-40%),元素A的氢化物化学式为H(8-a)A,结合A元素质量分数可得:
=94.1%,联立方程,解得b=32,A原子核中质子数与中子数相等,相对原子质量-质子数+中子数,所以质子数为16,则A为S;
C和D的原子序数分别比E和A的原子序数大1,故D为Cl;又C和D能形成CD3的化合物,故C县+3价,18g C和足量的稀H2SO4反应生成的H2在标准状况下的体积为22.4L,根据得失电子守恒,
×3=
×2,解得Mc=27g/mol,又C原子中有14个中子,所以C的质子数为13,为Al;C和D的原子序数分别比E和A的原子序数大1,故E为Mg;
(1)根据以上分析B的名称为钾,E离子的结构示意图为 ;
;
(2)根据以上分析ED2为MgCl2,根据形成过程方法书写;
(3)根据电子层数越大半径越大,电子层数相同时,核电荷数越大,半径越小来判断;
(4)C和E与B的最高价氧化物的水化物构成原电池即镁铝氢氧化钾原电池,在碱性溶液中铝比镁活泼,所以铝为负极,根据铝与碱的反应书写;
(5)设铵根的浓度为x K=
=
=2×10-5解得x=10-3
Q=(10-3)2×
=10-9>Ksp
所以溶液中有Mg(OH)2沉淀
A元素最高价氧化物中A原子与O原子数目之比为2:a,由A元素在其最高价氧化物中的含量是40%,则2b:16a=40%:(1-40%),元素A的氢化物化学式为H(8-a)A,结合A元素质量分数可得:
| b |
| 8-a+b |
C和D的原子序数分别比E和A的原子序数大1,故D为Cl;又C和D能形成CD3的化合物,故C县+3价,18g C和足量的稀H2SO4反应生成的H2在标准状况下的体积为22.4L,根据得失电子守恒,
| 18g |
| Mc |
| 22.4L |
| 22.4L/mol |
(1)根据以上分析B的名称为钾,E离子的结构示意图为
 ;
;(2)根据以上分析ED2为MgCl2,根据形成过程方法书写;
(3)根据电子层数越大半径越大,电子层数相同时,核电荷数越大,半径越小来判断;
(4)C和E与B的最高价氧化物的水化物构成原电池即镁铝氢氧化钾原电池,在碱性溶液中铝比镁活泼,所以铝为负极,根据铝与碱的反应书写;
(5)设铵根的浓度为x K=
| C(NH 4 +)C(OH -) |
| C(NH 3?H 2O) |
| x 2 |
| 0.05-x |
Q=(10-3)2×
| 0.002 |
| 2 |
所以溶液中有Mg(OH)2沉淀
解答:
解:令A元素最高正化合价为a,则最低负化合价为(a-8),A的相对分子质量为b,
A元素最高价氧化物中A原子与O原子数目之比为2:a,由A元素在其最高价氧化物中的含量是40%,则2b:16a=40%:(1-40%),元素A的氢化物化学式为H(8-a)A,结合A元素质量分数可得:
=94.1%,联立方程,解得b=32,A原子核中质子数与中子数相等,相对原子质量-质子数+中子数,所以质子数为16,则A为S;
C和D的原子序数分别比E和A的原子序数大1,故D为Cl;又C和D能形成CD3的化合物,故C县+3价,18g C和足量的稀H2SO4反应生成的H2在标准状况下的体积为22.4L,根据得失电子守恒,
×3=
×2,解得Mc=27g/mol,又C原子中有14个中子,所以C的质子数为13,为Al;C和D的原子序数分别比E和A的原子序数大1,故E为Mg;
(1)根据以上分析B的名称为钾,E离子的结构示意图为 故答案为:钾;
故答案为:钾;  ;
;
(2)根据以上分析ED2为MgCl2,其形成过程
故答案为: ;
;
(3)根据电子层数越大半径越大,电子层数相同时,核电荷数越大,半径越小,则A、C、D离子半径由小到大的顺序为S2->Cl->Al3+故答案:S2->Cl->Al3+
(4)C和E与B的最高价氧化物的水化物构成原电池即镁铝氢氧化钾原电池,在碱性溶液中铝比镁活泼,所以铝为负极,其反应为:Al-4OH-+3e-=AlO2-+2H2O,
故答案为:Al-4OH-+3e-=AlO2-+2H2O
(5)设铵根的浓度为x K=
=
=2×10-5解得x=10-3
Q=(10-3)2×
=10-9>Ksp
所以溶液中有Mg(OH)2沉淀,故答案为:溶液中有Mg(OH)2沉淀.
A元素最高价氧化物中A原子与O原子数目之比为2:a,由A元素在其最高价氧化物中的含量是40%,则2b:16a=40%:(1-40%),元素A的氢化物化学式为H(8-a)A,结合A元素质量分数可得:
| b |
| 8-a+b |
C和D的原子序数分别比E和A的原子序数大1,故D为Cl;又C和D能形成CD3的化合物,故C县+3价,18g C和足量的稀H2SO4反应生成的H2在标准状况下的体积为22.4L,根据得失电子守恒,
| 18g |
| Mc |
| 22.4L |
| 22.4L/mol |
(1)根据以上分析B的名称为钾,E离子的结构示意图为
 故答案为:钾;
故答案为:钾;  ;
;(2)根据以上分析ED2为MgCl2,其形成过程

故答案为:
 ;
;(3)根据电子层数越大半径越大,电子层数相同时,核电荷数越大,半径越小,则A、C、D离子半径由小到大的顺序为S2->Cl->Al3+故答案:S2->Cl->Al3+
(4)C和E与B的最高价氧化物的水化物构成原电池即镁铝氢氧化钾原电池,在碱性溶液中铝比镁活泼,所以铝为负极,其反应为:Al-4OH-+3e-=AlO2-+2H2O,
故答案为:Al-4OH-+3e-=AlO2-+2H2O
(5)设铵根的浓度为x K=
| C(NH 4 +)C(OH -) |
| C(NH 3?H 2O) |
| x 2 |
| 0.05-x |
Q=(10-3)2×
| 0.002 |
| 2 |
所以溶液中有Mg(OH)2沉淀,故答案为:溶液中有Mg(OH)2沉淀.
点评:本题考查元素推断、形成过程、半径比较、电化学原理、溶解平衡的有关计算,难度不大,注意掌握化学式中元素质量分数计算,推断元素是解题的关键.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、1 molCl2与足量Fe反应转移电子数一定为3NA |
| B、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C、1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D、标况下,11.2 L CCl4所含的分子数目为0.5NA |
下列说法正确的是( )
| A、金属氧化物都能与水反应生成碱 |
| B、非金属氧化物都能与水反应生成酸 |
| C、氧化铝既能与酸反应又能与氨水反应 |
| D、氧化铝坩埚不能用于熔融烧碱 |
铜易生锈,铜合金更易生锈,铜器上往往覆盖着一层铜绿,铜绿的主要成分是( )
| A、CuO |
| B、Cu(OH)2 |
| C、Cu2O |
| D、Cu2(OH)2CO3 |
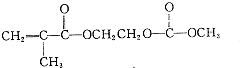
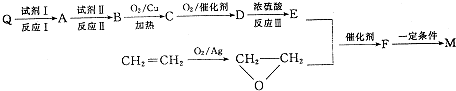
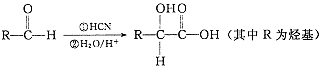
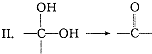
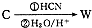 ,请写出符合下列条件的w的一种同分异构体的结构简式
,请写出符合下列条件的w的一种同分异构体的结构简式
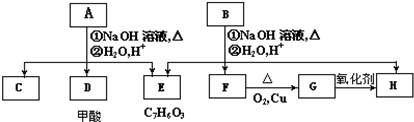
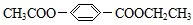 如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题:
如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题: