题目内容
8.X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的3倍,Z与X原子最外层电子数相同.回答下列问题:
(1)X、Y和Z的元素符号分别为H、O和Na.
(2)由Y和Z的两种单质可生成的一种淡黄色的固体化合物甲,则甲的化学式为Na2O2;生成甲的化学反应方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2.
(3)X2为气体,Y与碳可形成一种还原性气体乙.当X2和气体乙的混合物共1.6g与足量的Y2充分反应后,在15℃通入20.0g甲中充分反应后,所得固体的质量为21.6 g,所涉及的最后一步反应的化学方程式分别为2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2═2Na2CO3+O2.
(4)与Y同族且处于第四周期的元素的原子序数为34.
分析 (1)X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,为H元素;Y原子最外层电子数是其周期数的3倍,最外层电子数不超过8个,Z与X原子最外层电子数相同,则Z和X同一主族,则Z是Na元素,Y是O元素;
(2)由Y和Z的两种单质可生成的一种淡黄色的固体化合物甲是过氧化钠;钠和氧气在加热条件下反应生成过氧化钠;
(3)X2为气体,是氢气,氧气与碳可形成一种还原性气体乙为CO,当H2和气体CO的混合物共1.6g与足量的O2充分反应后,在15℃通入20.0gNa2O2中充分反应后,分别生成NaOH、Na2CO3,水蒸气和过氧化钠反应生成NaOH后固体质量增加量相当于m(H2),二氧化碳和过氧化钠反应生成生成碳酸钠固体质量增加量相当于m(CO);
(4)与Y同族且处于第四周期的元素是Se元素,其原子序数=8+8+18.
解答 解:(1)X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,为H元素;Y原子最外层电子数是其周期数的3倍,最外层电子数不超过8个,Z与X原子最外层电子数相同,则Z和X同一主族,则Z是Na元素,Y是O元素,
故答案为:H;O;Na;
(2)由Y和Z的两种单质可生成的一种淡黄色的固体化合物甲是过氧化钠,化学式为Na2O2;钠和氧气在加热条件下反应生成过氧化钠:反应方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,
故答案为:Na2O2;2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;
(3)X2为气体,是氢气,氧气与碳可形成一种还原性气体乙为CO,当H2和气体CO的混合物共1.6g与足量的O2充分反应后,在15℃通入20.0gNa2O2中充分反应后,分别生成NaOH、Na2CO3,水蒸气和过氧化钠反应生成NaOH后固体质量增加量相当于m(H2),二氧化碳和过氧化钠反应生成生成碳酸钠固体质量增加量相当于m(CO),所以反应后固体增加的质量等于氢气和CO的质量,为1.6g,最后固体质量为21.6g,最后的反应方程式分别为2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2═2Na2CO3+O2,
故答案为:21.6;2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2═2Na2CO3+O2;
(4)与Y同族且处于第四周期的元素是Se元素,其原子序数=8+8+18=34,
故答案为:34.
点评 本题考查原子结构和元素周期律的关系,为高频考点,侧重考查学生分析推断及对元素化合物知识的综合运用,明确原子结构、物质性质是解本题关键,注意同一主族元素原子序数计算方法,为易错点.

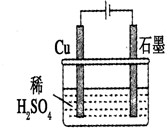
| A. | 石墨是电解池的负极,Cu是电解池的正极 | |
| B. | 电解过程中,铜电极上自身没什么变化 | |
| C. | 电解一定时间后,石墨电极上会有铜析出 | |
| D. | 整个电解过程中,溶液的pH不会变化 |
| A. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)=n(Fe2O3) | |
| B. | 混合粉末中物质的量之间一定满足:n(Fe)>n(Cu)>n(Fe2O3) | |
| C. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D. | 若a=72.50,b=1.12,则20.40g混合粉末中:n(Fe)=n(Cu)=0.05mol、n(Fe2O3)=0.09mol |
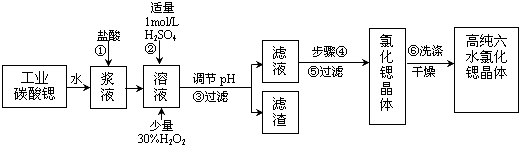
已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①中碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7
D氨水 E氢氧化锶粉末 F碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4(填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是A.
A.50~60℃B.80~100℃C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.



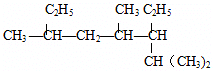 名称:2,4,6-三甲基-3-乙基辛烷
名称:2,4,6-三甲基-3-乙基辛烷 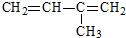 名称:2-甲基-1,3-丁二烯
名称:2-甲基-1,3-丁二烯
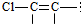 结构的有4种
结构的有4种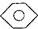 和
和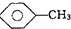 :KMnO4(H+)溶液.
:KMnO4(H+)溶液.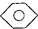 ,
,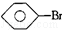 和C6H12(已烯):溴水.
和C6H12(已烯):溴水.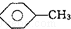 ,CCl4和乙醇:水.
,CCl4和乙醇:水. 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.