题目内容
18. 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.(1)写出两个工业生产过程中产生SO2的实例:
①化石燃料的燃烧.
②含硫矿石的冶炼.
(2)防治SO2污染可采用的措施有(写出三种):
①减少化石燃料的燃烧,大量使用清洁能源、②提高煤的燃烧利用率、③进行脱硫处理.
(3)湿式石灰石-石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法.其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏(CaSO4•2H2O),经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气.
①写出湿法石灰石-石膏法脱硫所涉及的化学反应方程式:SO2+CaCO3=CaSO3+CO2,2CaSO3+O2+4H2O=2(CaSO4•2H2O).
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:用石灰石浆液的成本较低.
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏.工业上消除可溶性氯化物的方法是用水洗涤.
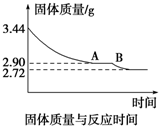
(4)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4•xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示.数据表明当固体的质量为2.72g后不再改变.求:
①石膏的化学式.
②图象中AB段对应化合物的化学式.
分析 (1)含硫的矿物燃烧或者含硫矿石的冶炼都会产生二氧化硫;
(2)依据减少二氧化硫的排放入手分析防治SO2污染可采用的措施;
(3)①湿法石灰石-石膏法脱硫,该过程中,二氧化硫与亚硫酸钙反应生成亚硫酸钙,亚硫酸钙不稳定容易被空气中氧气氧化生成硫酸钙;
②依据生产成本和经济效益解答;
③硫酸钙微溶于水,而氯化物易溶于水;
(4)根据题意可知加热前和加热后质量的减少量就是生成水的质量,由实验数据知3.44g CaSO4•xH2O完全分解得到无水CaSO42.72g,可知生成水的质量为:3.44g-2.72g=0.72g,由水的质量和硫酸钙的质量可推算出生石膏的化学式,再根据A-B段时石膏的质量为2.90g,其中CaSO42.72g,H2O0.18g,所以图象中产生AB段的原因是石膏的质量为2.90g,其中CaSO42.72g,H2O 为0.18g.此时其化学式可表示为2CaSO4•H2O.
解答 解:(1)工业生产过程中产生含硫矿石的燃烧和冶炼是排放二氧化硫的主要途径;要减少二氧化硫的污染,应从减少二氧化硫的排放入手,可以采取的措施有:减少化石燃料的燃烧,大量使用清洁能源;提高煤的燃烧利用率;进行脱硫处理等;
故答案为:①化石燃料的燃烧; ②含硫矿石的冶炼;
(2)防治SO2污染,可减少化石燃料的燃烧,大量使用清洁能源;提高煤的燃烧利用率;进行脱硫处理等,
故答案为:减少化石燃料的燃烧,大量使用清洁能源;提高煤的燃烧利用率;进行脱硫处理;
(3)①二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,反应方程式为:SO2+CaCO3=CaSO3+CO2,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4•2H2O,反应方程式为:2CaSO3+O2+4H2O=2(CaSO4•2H2O),
故答案为:SO2+CaCO3=CaSO3+CO2,2CaSO3+O2+4H2O=2(CaSO4•2H2O);
②二氧化硫雨石灰浆、熟石灰都反应,但石灰石浆液的价格低,故答案为:用石灰石浆液的成本较低;
③硫酸钙微溶于水,氯化物易溶于水,可用水洗涤,故答案为:用水洗涤;
(4)①石膏加热分解减少的质量就是水的质量,已知3.44g CaSO4•xH2O完全分解得到无水CaSO42.72g,则:
CaSO4•xH2O═CaSO4+xH2O
136 18x
2.72 0.72
解得x=2 所以石膏的化学式为CaSO4•2H2O;
答:石膏的化学式为CaSO4•2H2O;
②由实验数据知在A-B段时石膏的质量为2.90g,其中CaSO42.72g,H2O为2.90g-2.72g=0.18g.CaSO4的物质的量为$\frac{2.72g}{136g/mol}$=0.02mol,H2O的物质的量为$\frac{0.18g}{18g/mol}$=0.01mol,此时其化学式可表示为2CaSO4•H2O,
答:图象中AB段对应化合物的化学式为2CaSO4•H2O.
点评 本题考查煤的综合利用,为高频考点,侧重于学生的分析能力、计算能力的考查,题目涉及到二氧化硫对环境的污染及防治,氧化还原方程式的书写和结晶水合物的判断,题目难度中等,解题的关键是明确物质的性质,注意(4)题为易错点.

| A. | 由此可确定碘元素的相对原子质量为131 | |
| B. | $\stackrel{131}{53}$I是碘元素的一种同位素 | |
| C. | $\stackrel{131}{53}$I核素中含中子数为53 | |
| D. | $\stackrel{131}{53}$I2的摩尔质量为262 g |
| A. | Cu | B. | Si | C. | SiO2 | D. | Al2O3 |
| A. | 大量砍伐森林 | B. | 大量燃烧煤和石油等化石燃料 | ||
| C. | 水土流失 | D. | 汽车排放尾气剧增 |
| A. | 硫酸比盐酸稳定 | B. | 氯化氢比硫化氢稳定 | ||
| C. | 盐酸酸性比氢硫酸强 | D. | 亚硫酸酸性比高氯酸弱 |
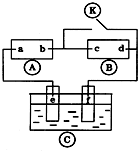 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. | c极发生的反应为2H++2e-=H2↑ | ||
| C. | f电极为锌板 | D. |  中溶液的溶质为FeSO4 中溶液的溶质为FeSO4 |
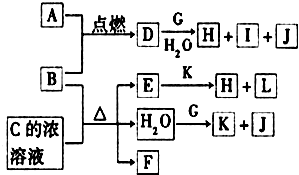 图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.
图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.