题目内容
常温下,下列溶液中各离子浓度关系正确的是( )
| A、等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3?H2O) |
| B、浓度为0.1 mol?L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、将pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A.等物质的量的氨水和盐酸混合后,两溶液恰好反应生成氯化铵,根据氯化铵溶液中的质子守恒判断;
B.碳酸钠溶液中存在物料守恒,根据物料守恒判断;
C.一水合氨为弱碱,pH=11的氨水与pH=3的盐酸等体积混合后发生反应生成氯化铵,氨水过量,溶液显示碱性,c(OH-)>c(H+);
D.醋酸溶液与NaOH溶液相混合后,所得溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可得:(Na+)=c(CH3COO-).
B.碳酸钠溶液中存在物料守恒,根据物料守恒判断;
C.一水合氨为弱碱,pH=11的氨水与pH=3的盐酸等体积混合后发生反应生成氯化铵,氨水过量,溶液显示碱性,c(OH-)>c(H+);
D.醋酸溶液与NaOH溶液相混合后,所得溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可得:(Na+)=c(CH3COO-).
解答:
解:A.等物质的量的氨水和盐酸混合后所得溶液为氯化铵溶液,氯化铵溶液中存在质子守恒:c(H+)=c(OH-)+c(NH3?H2O),故A正确;
B.碳酸钠溶液中存在物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C.一水合氨为弱碱,pH=11的氨水与pH=3的盐酸等体积混合后发生反应生成氯化铵,氨水过量,溶液显示碱性,溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.醋酸溶液与NaOH溶液相混合后,所得溶液为醋酸钠溶液,该溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所得溶液呈中性,则c(H+)=c(OH-),所以(Na+)=c(CH3COO-),故D错误;
故选A.
B.碳酸钠溶液中存在物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C.一水合氨为弱碱,pH=11的氨水与pH=3的盐酸等体积混合后发生反应生成氯化铵,氨水过量,溶液显示碱性,溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.醋酸溶液与NaOH溶液相混合后,所得溶液为醋酸钠溶液,该溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所得溶液呈中性,则c(H+)=c(OH-),所以(Na+)=c(CH3COO-),故D错误;
故选A.
点评:本题考查了溶液中离子浓度大小比较、酸碱混合的定性判断,题目难度中等,注意掌握酸碱混合的定性判断方法,明确弱电解质的部分电离特点,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中离子浓度大小.

练习册系列答案
相关题目
实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,以甲基橙为指示剂,用0.10mol?L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
| A、NaCl |
| B、Ca(OH)2 |
| C、Na2 CO3 |
| D、NaHCO3 |
在一定温度下,一定体积的密闭容器中有如下平衡:H2(气)+I2(气)?2HI(气)
已知H2和I2的起始浓度均为0.01mol?L-1时,达平衡时HI的浓度为0.16mol?L-1.若H2和I2的起始浓度均变为0.20mol?L-1,则平衡时H2的浓度(mol?L-1)是( )
已知H2和I2的起始浓度均为0.01mol?L-1时,达平衡时HI的浓度为0.16mol?L-1.若H2和I2的起始浓度均变为0.20mol?L-1,则平衡时H2的浓度(mol?L-1)是( )
| A、0.16 | B、0.08 |
| C、0.04 | D、0.02 |
对于淀粉和纤维素两种物质,下列说法正确的是( )
| A、二者都能水解,且水解的最终产物相同 |
| B、二者含有C、H、O三种元素的质量分数相同,因为互为同分异构体 |
| C、他们均属于糖类,且都是高分子化合物 |
| D、都可用(C6H10O5)n表示,但淀粉能发生银镜反应而纤维素不能 |
氢氧燃料电池的电解质溶液常见有硫酸和氢氧化钾两种,下列有关叙述正确的是( )
| A、此电池能发出蓝色的火焰 |
| B、氧气为正极,氢气为负极 |
| C、工作时电解液一定与H2反应 |
| D、负极:2H2+4OH--4e-═4H2O |
下列有关金属冶炼的说法中错误的是( )
| A、炼铁中加入焦炭作造渣剂 |
| B、炼钢中吹入氧气作氧化剂 |
| C、电解铝生产中加入冰晶石以降低氧化铝的熔点 |
| D、火法冶金比湿法冶金能耗大 |
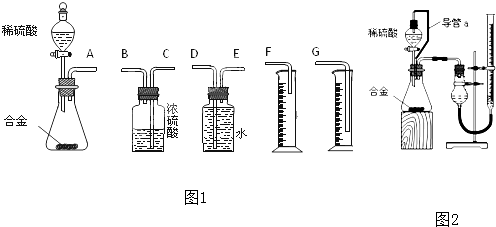
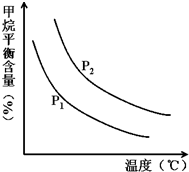 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: