题目内容
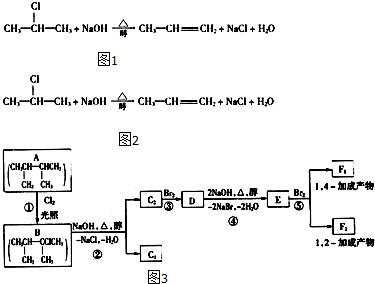
已知NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:据此回答下列问题:

(1)Ⅰ、Ⅱ、Ⅲ、IV四步中对于溶液和沉淀的分离采取的方法是 .
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式固体B ;沉淀D ;
(3)写出①、②、④四个反应的化学方程式,是离子反应的写出离子方程式
① ;② ;④ .

(1)Ⅰ、Ⅱ、Ⅲ、IV四步中对于溶液和沉淀的分离采取的方法是
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式固体B
(3)写出①、②、④四个反应的化学方程式,是离子反应的写出离子方程式
①
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中适量盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4、(NH4)2SO4和NH3?H2O,以此来解答.
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中适量盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4、(NH4)2SO4和NH3?H2O,以此来解答.
解答:
解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3;Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中适量盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E是K2SO4、(NH4)2SO4和NH3?H2O,
(1)对于溶液和沉淀的分离采取的方法是过滤,故答案为:过滤;
(2)由上述分析可知,固体B为Al2O3,D为Fe2O3,故答案为:Al2O3;Fe2O3;
(3)①、②反应的离子方程式分别为①Al2O3+2OH-=2AlO2-+H2O、②Al3++3NH3?H2O═Al(OH)3↓+3NH4+、④的方程式为2Al(OH)3
Al2O3+3H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al(OH)3
Al2O3+3H2O.
向沉淀中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3;Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中适量盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E是K2SO4、(NH4)2SO4和NH3?H2O,
(1)对于溶液和沉淀的分离采取的方法是过滤,故答案为:过滤;
(2)由上述分析可知,固体B为Al2O3,D为Fe2O3,故答案为:Al2O3;Fe2O3;
(3)①、②反应的离子方程式分别为①Al2O3+2OH-=2AlO2-+H2O、②Al3++3NH3?H2O═Al(OH)3↓+3NH4+、④的方程式为2Al(OH)3
| ||
故答案为:Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al(OH)3
| ||
点评:本题考查物质的分离实验,为高频考点,把握物质的性质及混合物分离提纯方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
下列各组比较中,前者大于后者的是( )
| A、中和体积与pH都相等的醋酸溶液和盐酸所消耗的NaOH的质量 |
| B、软水和硬水中Ca2+、Mg2+的含量 |
| C、硫酸工业中二氧化硫的催化氧化反应与合成氨生产中所采用的压强 |
| D、相同温度、相同浓度的NH4Cl和NH4HSO4溶液中c(NH4+) |
如图所示对实验仪器名称的标注或实验操作正确的是( )
A、 酸式滴定管 |
B、 氨气的制取 |
C、 Fe(OH)2的制取 |
D、 浓硫酸稀释 |
实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,以甲基橙为指示剂,用0.10mol?L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
| A、NaCl |
| B、Ca(OH)2 |
| C、Na2 CO3 |
| D、NaHCO3 |
有关水在人体中的作用,下列说法正确的是( )
| A、自来水是很好的饮用水 |
| B、水在人体内还有调节体温的作用 |
| C、饮用水越纯净越好 |
| D、没有污染的水就是纯净水 |
在一定温度下,一定体积的密闭容器中有如下平衡:H2(气)+I2(气)?2HI(气)
已知H2和I2的起始浓度均为0.01mol?L-1时,达平衡时HI的浓度为0.16mol?L-1.若H2和I2的起始浓度均变为0.20mol?L-1,则平衡时H2的浓度(mol?L-1)是( )
已知H2和I2的起始浓度均为0.01mol?L-1时,达平衡时HI的浓度为0.16mol?L-1.若H2和I2的起始浓度均变为0.20mol?L-1,则平衡时H2的浓度(mol?L-1)是( )
| A、0.16 | B、0.08 |
| C、0.04 | D、0.02 |
对于淀粉和纤维素两种物质,下列说法正确的是( )
| A、二者都能水解,且水解的最终产物相同 |
| B、二者含有C、H、O三种元素的质量分数相同,因为互为同分异构体 |
| C、他们均属于糖类,且都是高分子化合物 |
| D、都可用(C6H10O5)n表示,但淀粉能发生银镜反应而纤维素不能 |
下列物质的水溶液pH最大的是( )
| A、NaHCO3 |
| B、KHSO4 |
| C、AlCl3 |
| D、CH3COONa |