题目内容
4.下列各组离子可以大量共存的是( )| A. | 遇酚酞变红的溶液中:Na+、Cl-、Ba2+、CH3COO- | |
| B. | 常温下Kw/c(H+)=1×10-13mol/L的溶液中:SO42-、Fe2+、ClO-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol/L的溶液中:Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol/LAlCl3溶液中可能大量存在:Ca2+、AlO2-、K+、CO32- |
分析 A.遇酚酞变红的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
B.常温下Kw/c(H+)=1×10-13mol/L的溶液中存在大量氢离子,次氯酸根能够氧化亚铁离子,次氯酸根离子与氢离子反应生成次氯酸;
C.水电离出的c(H+)=10-10mol/L的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子和氢氧根离子反应;
D.钙离子与碳酸根离子反应生成碳酸钙沉淀,铝离子与偏铝酸根离子、碳酸根离子发生双水解反应.
解答 解:A.遇酚酞变红的溶液为碱性溶液,溶液中存在大量氢氧根离子,Na+、Cl-、Ba2+、CH3COO-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.常温下Kw/c(H+)=1×10-13mol/L的溶液为酸性溶液,溶液中存在大量氢离子,ClO-与氢离子反应生成次氯酸,Fe2+、ClO-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.水电离出的c(H+)=10-10mol/L的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子、氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Ca2+、CO32-之间反应生成碳酸钙,氯化铝电离出的铝离子与AlO2-、CO32-发生双水解反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOC-COOH | D. | CH3COOH |
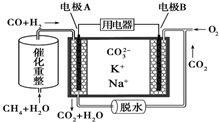
| A. | 放电时负极有CO2生成 | |
| B. | 正极反应为O2+2CO2+4e-═2CO32- | |
| C. | 反应CH4+H2O$→_{△}^{催化剂}$3H2+CO,每消耗1molCH4转移6mol 电子 | |
| D. | 该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
| A. | 乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键 | |
| B. | 开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 制造玻璃是复杂的物理变化,玻璃的组成不同,性能不同 |
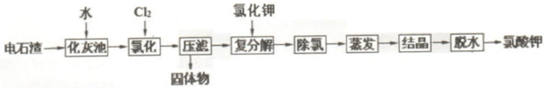
已知:①几种物质溶解度与温度的关系
| 温度/ | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
(1)某导电塑料是以乙炔为单体加聚合成,其化学为
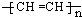 .
.(2)化灰池中为加快水浸的速度,常采取的措施搅拌、加热.
(3)为除去Fe/Al 等杂质,氯化过程中需要控制溶液 pH为6-7.
(4)氯化过程的温度控制在 75~80℃,该过程主要反应的离子方程式为6Cl2+6Ca(OH)2=6Ca2++10Cl-+2ClO3-. 温度过低会发生副反应,产生的副产物为Ca(ClO)2(写化学式).
(5)复分解反应中,常控制温度为 20℃,加入KCl 发生的反应的方程式Ca(ClO3)2+2KCl=CaCl2+2KClO3+6H2O.
(6)通常用石墨电极电解 KClO 溶液制备 KClO3,则阳极的电极反应方程式为ClO--4e-+2H2O=ClO3-+4H+.
脱水过程实现固液分离,工业常用的设备是C
A.蒸馏塔 B.反应釜 C.离心机 D.交换器
(7)现代工艺氯化时通入O2做氧化剂提高效率,其氯化的化学方程式为2Ca(OH)2+2Cl2+5O2=2Ca(ClO3)2+2H2O.
| A. | 硫酸镁溶液加氨水:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| B. | 碳酸氢铵溶液加足量氢氧化钠并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| C. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O |
| A. | 闪电时,N2变为NO | B. | NO被空气中O2氧化为NO2 | ||
| C. | 工业上,用N2合成氨 | D. | 豆科植物根瘤菌把N2变成NH3 |