题目内容
依据元素周期表及元素周期律,下列推断正确的是( )
| A、含有离子键和共价键的化合物一定是离子化合物 |
| B、元素原子的最外层电子数等于该元素的最高化合价 |
| C、由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| D、VIIA族元素阴离子的还原性越强,元素最高价氧化物对应水化物的酸性也越强 |
考点:元素周期律和元素周期表的综合应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.含离子键的化合物一定为离子化合物;
B.主族元素的最外层电子数等于该元素的最高化合价,且O、F除外;
C.不能利用无氧酸的酸性比较非金属性;
D.VIIA族元素阴离子的还原性越强,对应元素的非金属性越弱.
B.主族元素的最外层电子数等于该元素的最高化合价,且O、F除外;
C.不能利用无氧酸的酸性比较非金属性;
D.VIIA族元素阴离子的还原性越强,对应元素的非金属性越弱.
解答:
解:A.含离子键的化合物一定为离子化合物,离子化合物中可存在共价键,故A正确;
B.主族元素的最外层电子数等于该元素的最高化合价,O、F除外,O、F没有正价,且副族元素一般不存在此规律,故B错误;
C.不能利用无氧酸的酸性比较非金属性,比较角度不合理,应利用元素最高价氧化物对应水化物的酸性比较Cl、S的非金属性,故C错误;
D.VIIA族元素阴离子的还原性越强,对应元素的非金属性越弱,则元素最高价氧化物对应水化物的酸性越弱,故D错误;
故选A.
B.主族元素的最外层电子数等于该元素的最高化合价,O、F除外,O、F没有正价,且副族元素一般不存在此规律,故B错误;
C.不能利用无氧酸的酸性比较非金属性,比较角度不合理,应利用元素最高价氧化物对应水化物的酸性比较Cl、S的非金属性,故C错误;
D.VIIA族元素阴离子的还原性越强,对应元素的非金属性越弱,则元素最高价氧化物对应水化物的酸性越弱,故D错误;
故选A.
点评:本题考查元素周期表和元素周期律的综合应用,为高频考点,把握元素的位置、性质及规律性知识的应用为解答的关键,选项C为解答的易错点,题目难度不大.

练习册系列答案
相关题目
下列关于油脂的叙述中正确的是( )
| A、油脂属于酯类 |
| B、天然油脂大多为单甘油酯 |
| C、油脂都不能使溴水或酸性高锰酸钾溶液褪色 |
| D、油脂在常温下的存在状态主要决定于分子中碳原子数的多少 |
100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气总量,可采用的方法是( )
| A、加入少量浓盐酸 |
| B、加入几滴氯化铜溶液 |
| C、加入少量铁粉 |
| D、加入适量的氯化钠溶液 |
常温时,有等体积,pH均为2的盐酸和醋酸溶液,下列说法正确的是( )
| A、分别中和等质量的氢氧化钠,消耗盐酸和醋酸溶液的体积相同 |
| B、分别跟足量的镁完全反应,无法比较两者产生氢气的总量大小 |
| C、滴入2滴甲基橙试液后加入等体积的pH=12的Ba(OH)2,溶液仍呈红色 |
| D、分别加水稀释相同的倍数,盐酸中由水电离出的c(H+)比醋酸溶液大 |
某反应△H=+100kJ?mol-1,下列有关该反应的叙述正确的是( )
| A、正反应活化能小于100kJ?mol-1 |
| B、逆反应活化能一定小于100kJ?mol-1 |
| C、逆反应活化能大于正反应活化能 |
| D、正反应活化能不小于100kJ?mol-1 |
下列叙述正确的是( )
| A、用丁达尔现象可以区分乙醇溶液和淀粉溶液 |
| B、16O转化为18O属于化学变化 |
| C、实验室中,钠通常保存在盛有煤油的细口瓶中 |
| D、定容时仰视容量瓶刻度线,所配制的NaOH溶液浓度将偏高 |
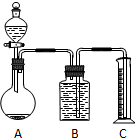 甲.乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲.乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.