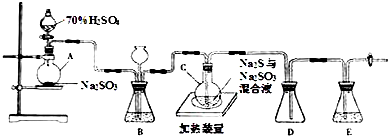
题目内容
1.已知X、Y、Z、W、R均为短周期元素,且原子序数依次增大.X、W同主族,X与其他元素均不同周期,Y、Z、R三种元素在周期表中的位置如图所示,且Y、Z的单质在常温下为无色气体.下列说法正确的是( )| Y | Z |
| R |
| A. | R的氧化物对应的水化物一定是强酸 | |
| B. | X、Y、Z三种元素既能形成共价化合物又能形成离子化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10个电子的微粒有2种 | |
| D. | Z、W形成的化合物中只能含有离子键 |
分析 X、Y、Z、W、R均为短周期元素,且原子序数依次增大.X、W同主族,X与其他元素均不同周期,则X为H,W为Na,结合Y、Z、R三种元素在周期表中的位置,且Y、Z的单质在常温下为无色气体,则Y为N,Z为O,R为S,然后结合元素周期律及元素化合物知识来解答.
解答 解:X、Y、Z、W、R均为短周期元素,且原子序数依次增大.X、W同主族,X与其他元素均不同周期,则X为H,W为Na,结合Y、Z、R三种元素在周期表中的位置,且Y、Z的单质在常温下为无色气体,则Y为N,Z为O,Z与R同主族,R为S,
A.若为亚硫酸为弱酸,故A错误;
B.X、Y、Z三种元素既能形成共价化合物(硝酸)又能形成离子化合物(硝酸铵),故B正确;
C.由X、Y、Z三种元素中的任意两种组成的具有10个电子的微粒有NH2-、OH-、H2O、NH3、H3O+、NH4+等,故C错误;
D.Z、W形成的化合物Na2O2中含有离子键、O-O共价键,故D错误;
故选B.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、元素化合物知识推断元素等为解答的关键,侧重分析与推断能力的考查,注意周期律及元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
12.化学与我们的生活息息相关,下列有关说法正确的是( )
| A. | 绿色化学的核心理念是对环境污染进行综合治理 | |
| B. | 现代研制的油漆中一般不使用甲醛等化合物,因为这些化合物对人体有害 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |
9.化学在生活中发挥着重要的作用,下列说法正确的是( )
| A. | 食用油脂饱和程度越大,熔点越高 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 纯铁易被腐蚀,可以在纯铁中混入碳元素制成“生铁”,以提高其抗腐蚀能力 | |
| D. | 光纤通信是现代化的通信手段,光导纤维的主要成分是晶体硅 |
10.分子式为C3H6O2的有机物有多种同分异构体,现有其中的四种X、Y、Z、W,它们的分子中均含甲基,将它们分别进行下列实验以鉴别,其实验记录如下:
回答下列问题:
(1)写出四种物质的结构简式X:CH3CH2COOH,Y:CH3CHOHCHO,Z:HCOOCH2CH3,W:CH3COOCH3.
(2)①Y与新制Cu(OH)2悬浊液反应的化学方程式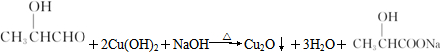 .
.
②Z与NaOH溶液反应的化学方程式HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 悬浊液 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
(1)写出四种物质的结构简式X:CH3CH2COOH,Y:CH3CHOHCHO,Z:HCOOCH2CH3,W:CH3COOCH3.
(2)①Y与新制Cu(OH)2悬浊液反应的化学方程式
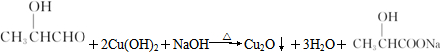 .
.②Z与NaOH溶液反应的化学方程式HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH.
11.甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验).
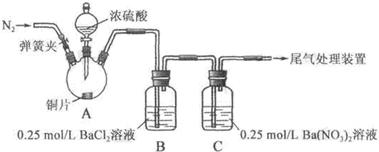
实验操作和现象:
(1)A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)C中白色沉淀是BaSO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2═2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:
(5)合并(4)中两同学的方案进行实验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.

实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是BaSO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2═2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
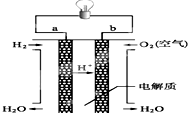 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
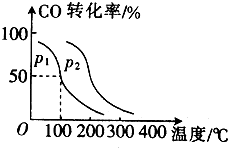 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气.