题目内容
15.A、B、C、D、E是位于短周期的主族元素.已知:①热稳定性:HmD>HmC;
②Cm-、E(m-1)- 具有相同的电子层结构;
③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;
④A与B质子数之和是D质子数的3倍.
依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式
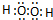 .
.(2)能证明Cm-、E(m-1)- 的还原性强弱的离子方程式为Cl2+S2-=2Cl-+S↓.
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O.常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式H2S+OH-=HS-+H2O.
分析 短周期元素中,由③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,则A处于IA族,B的离子半径最小,则B为金属元素,由④中A与B质子数之和是D质子数的3倍,则A、B只能处于第三周期,可知A为Na,B为Al,则D的质子数为$\frac{11+13}{3}$=8,故D为O元素;由①热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素,以此解答该题.
解答 解:短周期元素中,由③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,则A处于IA族,B的离子半径最小,则B为金属元素,由④中A与B质子数之和是D质子数的3倍,则A、B只能处于第三周期,可知A为Na,B为Al,则D的质子数为$\frac{11+13}{3}$=8,故D为O元素;由①热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素.
(1)HmDm为H2O2,电子式为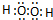 ,故答案为:
,故答案为: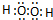 ;
;
(2)由于非金属性Cl>S,单质的氧化性Cl2>S,单质的氧化性越强,对应阴离子的还原性越弱,则有还原性:S2->Cl-,可通过反应Cl2+S2-=2Cl-+S↓证明,
故答案为:Cl2+S2-=2Cl-+S↓;
(3)E的单质为氯气,A与D形成的化合物的水溶液为NaOH溶液,在常温下氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
常温下,将等物质的量浓度的H2S溶液和NaOH溶液等体积混合,该反应的离子方程式为H2S+OH-=HS-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;H2S+OH-=HS-+H2O.
点评 本题考查位置结构性质的关系及应用、常用化学用语、元素化合物性质等,正确推断元素的种类为解答该题的关键.

| A. | 能使紫色石蕊变红 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 该有机物不能与NaOH发生反应 | |
| D. | 1mol该有机物只能与1mol Br2发生加成反应 |
| A. | Al2O3 熔点高,可用于制作耐高温仪器 | |
| B. | 水果、蔬菜等是碱性食物 | |
| C. | 高纯度的硅单质可用于制作光导纤维 | |
| D. | 绿色化学的核心是从源头上杜绝污染的产生 |
| A. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用水鉴别乙醇、苯和溴苯 |


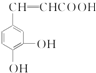 跟碳酸氢钠:
跟碳酸氢钠: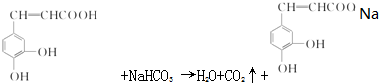 .
.

 ,B
,B .
. +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$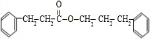 +H2O.
+H2O.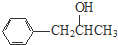 、
、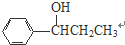 、
、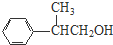 、
、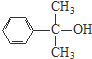 .
.