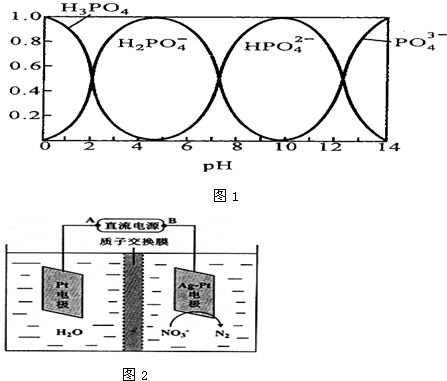
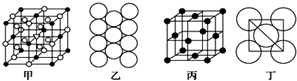
题目内容
关于化学计量的应用,下列说法正确的是( )
| A、室温下,106g碳酸钠固体所含有的离子总的物质的量小于3mol |
| B、在同压不同温的情况下,质量相同的氧气和臭氧所含氧原子数不相同 |
| C、将物质的量浓度分别为1mol/L和2mol/L的硫酸等质量混合(假设体积可以加和),则混合后硫酸溶液的浓度为1.5mol/L |
| D、标况下,22.4L CH3Cl分子数约为6.02×1023 |
考点:物质的量的相关计算
专题:计算题,化学用语专题
分析:A.结合n=
及物质构成分析;
B.质量相同的氧气和臭氧,氧原子质量相同,结合n=
及N=nNA分析;
B.结合c=
及硫酸浓度越大密度越大分析;
D.结合n=
及N=nNA分析.
| m |
| M |
B.质量相同的氧气和臭氧,氧原子质量相同,结合n=
| m |
| M |
B.结合c=
| n |
| V |
D.结合n=
| V |
| Vm |
解答:
解:室温下,106g碳酸钠固体,其物质的量为
=1mol,含钠离子和碳酸根离子,则所含有的离子总的物质的量为3mol,故A错误;
B.质量相同的氧气和臭氧,氧原子质量相同,由n=
可知,氧原子物质的量相同,则由N=nNA可知,原子个数相同,故B错误;
C.等质量混合,硫酸浓度越大密度越大,则体积不同,c=
,ρ2>ρ1,则混合后硫酸溶液的浓度不等于1.5mol/L,故C错误;
D.标况下,22.4L CH3Cl,其物质的量为
=1mol,所以分子数约为6.02×1023,故D正确;
故选D.
| 106g |
| 106g/mol |
B.质量相同的氧气和臭氧,氧原子质量相同,由n=
| m |
| M |
C.等质量混合,硫酸浓度越大密度越大,则体积不同,c=
| ||||
|
D.标况下,22.4L CH3Cl,其物质的量为
| 22.4L |
| 22.4L/mol |
故选D.
点评:本题考查物质的量的计算,为高频考点,把握以物质的量为中心的计算公式为解答的关键,侧重分析能力、计算能力的考查,选项C为解答的易错点,题目难度中等.

练习册系列答案
相关题目
如部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )


| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质能从M与R元素构成的盐溶液中置换出单质M |
炼钢时常用的氧化剂是空气(或纯氧).炼钢过程中既被氧化又被还原的元素是( )
| A、铁 | B、硫 | C、氧 | D、碳 |
下列实验,能达到实验目的是( )
A、 配置一定物质的量浓度的H2SO4溶液 |
B、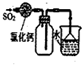 收集和吸收多余的SO2 |
C、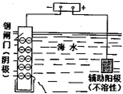 保护钢闸门不被腐蚀 |
D、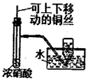 制取和收集NO2 |
下列离子或分子组中大量共存且满足相应要求的是( )
| A、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体 |
| C、Na+、K+、Ag+、NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 |
| D、NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体 |
人的血液中存在H2CO3~HCO3-这样“一对”物质,前者的电离和后者的水解两个平衡使正常人血液的pH保持在7.35~7.45之间.血液中注射碱性物质时,上述电离和水解受到的影响分别是( )
| A、促进、促进 |
| B、促进、抑制 |
| C、抑制、促进 |
| D、抑制、抑制 |
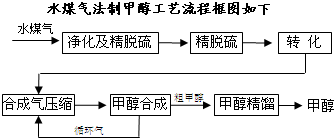 将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.