题目内容
6.设NA为阿伏加德罗常数值,下列说法不正确的是( )| A. | 1 mol HNO3见光分解,转移的电子数为4NA | |
| B. | 25℃时,1LpH=1的H2SO4溶液中含有的H+数为0.1NA | |
| C. | 28 g乙烯与丙烯的混合物中含有的共用电子对数为6NA | |
| D. | 将0.5molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+的数目为0.5NA |
分析 A.据4HNO3=4NO2↑+O2↑+2H2O~4mole-,据此进行分析;
B.pH=1的H2SO4溶液中c(H+)=0.1mol/L,根据n=cV计算H+的物质的量,再根据N=nNA计算H+-数目;
C.1个乙烯分子含有4个C-H、1个C=C,共用电子对为6对,1个丙烯分子中含有6个C-H、1个C-C、1个C=C,共用电子对为9对,利用极限的思想分别求乙烯和丙烯的公用电子对,最后共用电子对数应该在两者之间;
D.根据电荷守恒n(NH4+)+n(H+)=n(NO3-)+n(OH-),溶液呈中性故n(H+)=n(OH-),则n(NH4+)=n(NO3-)=0.5mol,据此进行分析.
解答 解:A.据4HNO3=4NO2↑+O2↑+2H2O~4mole-,故1 mol HNO3见光分解,转移的电子数为NA,故A错误;
B.pH=1的H2SO4溶液中c(H+)=0.1mol/L,N(H+)=1L×0.1mol/L×NAmol-1=0.1NA,故B正确;
C.假设28g都是乙烯,则n(C2H4)=$\frac{28g}{28g/mol}$=1mol,1mol乙烯共用电子对数为6NA,假设28g都是丙烯,则n(C3H6)=$\frac{28g}{42g/mol}$=$\frac{2}{3}$mol,$\frac{2}{3}$mol丙烯共用电子对数为$\frac{2}{3}$×9NA=6NA,故28g乙烯和丙烯混合物含有共用电子对的数目为6NA,故C正确;
D.根据电荷守恒n(NH4+)+n(H+)=n(NO3-)+n(OH-),溶液呈中性故n(H+)=n(OH-),则n(NH4+)=n(NO3-)=0.5mol,即NH4+的数目为0.5NA,故D正确,
故选A.
点评 本题考查了阿伏伽德罗常数的分析应用,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度不大.

 阅读快车系列答案
阅读快车系列答案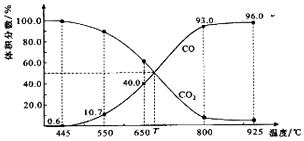
| A. | 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总 |
| A. | 向Na[Al(OH)4]溶液中通入足量CO2:2[Al(OH)4]-+CO2═2Al(OH)3↓+CO32-+H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O |

| A. | 含有5种官能团 | |
| B. | 分子式为C9H9O6 | |
| C. | 可以发生取代、加成、消去、氧化反应 | |
| D. | 核磁共振氢谱具有6个峰 |
| A. | CH3COOH与C2H518OH在浓硫酸作用下加热,反应生成的有机物分子的结构简式为CH3COOC2H5 | |
| B. | 可以用饱和碳酸钠溶液鉴别乙醇、乙酸、苯和四氯化碳 | |
| C. | 有机物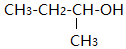 的名称为1-甲基-1-丙醇 的名称为1-甲基-1-丙醇 | |
| D. | 向淀粉溶液中加入少量稀硫酸后煮沸几分钟,冷却后加入银氨溶液,水浴加热一段时间没有银镜产生,说明淀粉仍未水解 |
| A. | 14g 分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | Na2O2与H2O的反应中每生成0.1molO2,转移电子数目为0.4NA | |
| C. | 常温常压下,1.7g NH3所含电子数为0.8NA | |
| D. | 标准状况下,11.2L NO与11.2LO2混合,原子总数小于2NA |
| 实验 | 现象 | 结论 | |
| A. | 向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D. | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
 (1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式
(1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式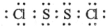 .
. 现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.
现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.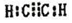 (写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.
(写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.