题目内容
19.下列离子方程式不正确的是( )| A. | 乙酸乙酯在强碱性环境下水解:CH3CO18OC2H5+OH-$\stackrel{△}{→}$ CH3COO -+C2H518OH | |
| B. | 苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O $\stackrel{△}{→}$ C6H5OH+CO32- | |
| C. | 醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2═Cu2++2CH3COO-+2H2O | |
| D. | 溴乙烷在氢氧化钠水溶液中的反应:CH3CH2Br+OH-$\stackrel{△}{→}$CH3CH2OH+Br- |
分析 A.酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水;
B.不符合反应客观事实;
C.醋酸溶液与氢氧化铜反应生成醋酸铜和水;
D.卤代烃在碱性环境下水解生成醇.
解答 解:A.乙酸乙酯在强碱性环境下水解,离子方程式:CH3CO18OC2H5+OH-$\stackrel{△}{→}$ CH3COO -+C2H518OH,故A正确;
B.苯酚钠溶液中通入二氧化碳反应生成苯酚和碳酸氢钠,离子方程式:C6H5O-+CO2+H2O $\stackrel{△}{→}$ C6H5OH+HCO3-,故B错误;
C.醋酸溶液与氢氧化铜反应生成醋酸铜和水,离子方程式:2CH3COOH+Cu(OH)2═Cu2++2CH3COO-+2H2O,故C正确;
D.溴乙烷在氢氧化钠水溶液中的反应,离子方程式:CH3CH2Br+OH-$\stackrel{△}{→}$CH3CH2OH+Br-,故C正确;
故选:B.
点评 本题考查了离子方程式书写正误判断,侧重考查有机物参加的离子反应,明确酯化反应原理、氯代烃、苯酚的性质即可解答,题目难度不大.

练习册系列答案
相关题目
10.已知断开1mol H-H键,1molN-H键、1mol N≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,则1mol H2生成NH3需( )
| A. | 吸收能量92kJ | B. | 放出能量92kJ | C. | 放出能量30.67kJ | D. | 吸收能量30.67kJ |
7.从原子序数11依次增加到17,下列所叙递变关系错误的是( )
| A. | 电子层数逐渐增多 | B. | 原子核吸引电子的能力逐渐增强 | ||
| C. | 最高正价数值逐渐增大 | D. | 从硅到氯负价从-4到-1 |
14.能说明苯环对羟基有影响,使羟基变得活泼的事实是( )
| A. | 苯酚能和溴水迅速反应 | B. | 苯酚具有极弱酸性 | ||
| C. | 室温时苯酚不易溶解于水 | D. | 液态苯酚能与钠反应放出氢气 |
4.已知元素的电负性、电离能和原子半径等内容一样,也是元素的一种基本性质,
(1)下面给出14种元素的电负性:
试结合元素周期律知识完成下列问题:
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐增大,同主族元素从上至下,电负性逐渐减小.
②预测元素电负性的大小关系:Br>I,电负性最小的元素在周期表中的位置是第6周期ⅠA族(放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所 需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子时所需的能量要远远大于失去第1个电子所需的能量Li原子失去1个电子后形成稳定结构再失1个电子困难.
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar(均填元素符号).
(1)下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐增大,同主族元素从上至下,电负性逐渐减小.
②预测元素电负性的大小关系:Br>I,电负性最小的元素在周期表中的位置是第6周期ⅠA族(放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所 需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar(均填元素符号).
8.短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素原子的内层电子数是最外层电子数的一半,则下列说法不正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | Q的一种核素质量数是A,则其中子数是A-17 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | W简单阴离子失电子能力比Q简单阴离子强 | |
| D. | 由X元素组成的单质有多种,它们之间互称同素异形体 |
9.下列说法或表示法不正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 在热化学方程式中无论是反应物还是生成物必须表明聚集状态 |
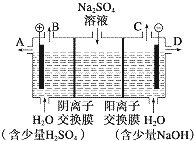 某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
 .
.