题目内容
7.从原子序数11依次增加到17,下列所叙递变关系错误的是( )| A. | 电子层数逐渐增多 | B. | 原子核吸引电子的能力逐渐增强 | ||
| C. | 最高正价数值逐渐增大 | D. | 从硅到氯负价从-4到-1 |
分析 同周期,具有相同电子层数,从左向右元素的非金属性增强,原子半径在减小,最高正价在增大,最低负极由硅的-4价升高为-1价.以此来解答.
解答 解:A.同周期,具有相同电子层数,故A错误;
B.同周期,从左向右,质子数越多,对最外层电子的吸引越强,故B正确;
C.同周期,从左向右,最外层电子数逐渐增大,则最高正价在逐渐增大,故C正确;
D.最低负化合价,等于最外层电子数-8,硅到氯最外层电子数由4增加为7,最低负极从硅到氯负价从-4升高为-1,故D正确.
故选A.
点评 本题考查同周期元素性质的变化规律,明确原子结构与元素性质的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
17. 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)下列措施中能使平衡常数K增大的是a(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8min内,CO的平均反应速率v(CO)=0.0625mol•L-1•min-1.
(4)1 100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
①下列说法正确的是BC.
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=0.67mol•L-1、φ1=33.3%、α2=55.5%.
 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)下列措施中能使平衡常数K增大的是a(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8min内,CO的平均反应速率v(CO)=0.0625mol•L-1•min-1.
(4)1 100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、2mol CO2 | 4mol FeO、3mol CO |
| CO的浓度(mol•L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=0.67mol•L-1、φ1=33.3%、α2=55.5%.
12.洗涤做过银镜反应的试管时,所用的试剂是( )
| A. | 氨水 | B. | NaOH溶液 | C. | 硝酸 | D. | 酒精 |
19.下列离子方程式不正确的是( )
| A. | 乙酸乙酯在强碱性环境下水解:CH3CO18OC2H5+OH-$\stackrel{△}{→}$ CH3COO -+C2H518OH | |
| B. | 苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O $\stackrel{△}{→}$ C6H5OH+CO32- | |
| C. | 醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2═Cu2++2CH3COO-+2H2O | |
| D. | 溴乙烷在氢氧化钠水溶液中的反应:CH3CH2Br+OH-$\stackrel{△}{→}$CH3CH2OH+Br- |
16.从碳骨架形状进行分类,关于下列各有机物的说法中正确的是( )
①CH3CH2Cl②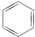 ③(CH3)2C=CH2④
③(CH3)2C=CH2④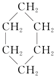 ⑤
⑤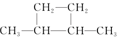
①CH3CH2Cl②
 ③(CH3)2C=CH2④
③(CH3)2C=CH2④ ⑤
⑤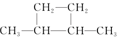
| A. | 链状烃:①③⑤ | B. | 链状烃:③⑤ | C. | 环状烃:②④⑤ | D. | 芳香烃:②④ |
17.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变为棕黄色,说明氯水中含有HClO | |
| C. | 向氯水中滴加稀硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
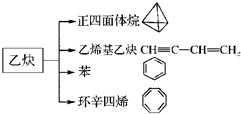 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: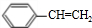 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$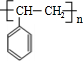
 、
、 .
. CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.