题目内容
10.已知断开1mol H-H键,1molN-H键、1mol N≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,则1mol H2生成NH3需( )| A. | 吸收能量92kJ | B. | 放出能量92kJ | C. | 放出能量30.67kJ | D. | 吸收能量30.67kJ |
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,反应热=化学键断裂吸收的总能量-化学键形成放出的总能量.
解答 解:1mol H2生成NH3的反应热=$\frac{1}{3}$×946kJ+436kJ-$\frac{2}{3}$×3×391kJ=-30.67kJ,所以是放出热量,
故选C.
点评 本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
相关题目
20.某有机物6.4g在氧气中完全燃烧,生成8.8gCO2和7.2g水,下列说法正确的是( )
| A. | 该有机物仅含碳、氧两种元素 | |
| B. | 该有机物中碳、氧、氧原子个数比为1:4:2 | |
| C. | 无法确定是否含有氧元素 | |
| D. | 该有机物中一定含有氧元素 |
1.下列物质属于不等电子体的是( )
| A. | CH4和NH4+ | B. | B3H6N3和C6H6 | C. | CO2、N2O | D. | H2O和CH4 |
5.下列有关放热反应、吸热反应的说法不正确的是( )
| A. | 吸热反应的发生都需要加热,放热反应在常温下一定容易发生 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
19.下列离子方程式不正确的是( )
| A. | 乙酸乙酯在强碱性环境下水解:CH3CO18OC2H5+OH-$\stackrel{△}{→}$ CH3COO -+C2H518OH | |
| B. | 苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O $\stackrel{△}{→}$ C6H5OH+CO32- | |
| C. | 醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2═Cu2++2CH3COO-+2H2O | |
| D. | 溴乙烷在氢氧化钠水溶液中的反应:CH3CH2Br+OH-$\stackrel{△}{→}$CH3CH2OH+Br- |
20.下列化学用语正确的是( )
| A. | 钾原子的结构示意图为 | B. | 水分子的结构式:H-O-H | ||
| C. | NH3的电子式为 | D. | NaOH的电子式为Na+[OH]- |
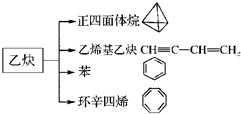 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: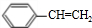 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$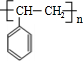
 、
、 .
. CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.