题目内容
15.NA表示阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,11.2L的戊烷含有分子数为0.5NA | |
| B. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| C. | 1mol甘氨酸(α-氨基乙酸)分子中存在9NA对共用电子 | |
| D. | 1L0.1mol/L的苯酚分子数为0.1NA |
分析 A、标况下戊烷为液态;
B、乙烯和丙烯的最简式均为CH2;
C、甘氨酸中含10对共用电子对;
D、苯酚显弱酸性,能微弱电离.
解答 解:A、标况下戊烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、乙烯和丙烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含3mol原子即3NA个,故B正确;
C、1个甘氨酸 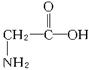 含有8个单键,1个双键,所以分子中存在10对共用电子,故C错误;
含有8个单键,1个双键,所以分子中存在10对共用电子,故C错误;
D、苯酚显弱酸性,能微弱电离,故溶液中的苯酚分子数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.有A、B、C、D四种元素的离子A+、B2+、C-、D2-,它们具有相同的电子数,下列判断中,正确的是( )
| A. | A、B、C、D四种元素可能属于同一周期 | |
| B. | A、B、C、D四种元素一定属于短周期元素 | |
| C. | 原子序数由大到小的顺序是B>A>C>D | |
| D. | 离子半径由大到小的顺序是、B2+>A+>C->D2- |
6.下列说法正确的是( )
| A. | 可逆反应的特征是正反应速率和逆反应速率相等 | |
| B. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 | |
| C. | 在其他条件不变时,升高温度可以使平衡向正反应方向移动 | |
| D. | 对于反应A(g)+3B(g)?2C(g)△H<0达平衡后,温度降低,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
20.已知同一碳原子连有两个羟基不稳定: .下列关于有机物
.下列关于有机物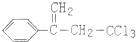 (除草剂,俗称稗草烯)的说法不正确的是( )
(除草剂,俗称稗草烯)的说法不正确的是( )
 .下列关于有机物
.下列关于有机物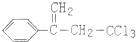 (除草剂,俗称稗草烯)的说法不正确的是( )
(除草剂,俗称稗草烯)的说法不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 在足量NaOH溶液中充分水解,可生成羧酸钠 | |
| C. | 可用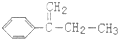 与Cl2在光照条件下通过取代反应获得较纯的该物质 与Cl2在光照条件下通过取代反应获得较纯的该物质 | |
| D. | 在一定条件下可发生聚合反应 |
5.1838年李比希提出了“基团”的定义,从此,有机化学中“基团”概念就确定了,下列有机基团的表达式不正确的是( )
| A. | 甲基-CH3 | B. | 羟基-OH- | C. | 醛基-CHO | D. | 羧基-COOH |