题目内容
7.黄铜矿的主要成分是CuFeS2(硫元素显-2价,铁元素显+2价).实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
已知:CuFeS2+O2$\frac{\underline{\;高温\;}}{\;}$Cu+FeS+SO2 FeS+2HCl═FeCl2+H2S↑
(1)在实验室中,应将黄铜矿粉末放在坩埚(填仪器名称)中焙烧.
(2)将反应过程中产生的SO2和H2S通入如图所示装置中检验它们的性质.该实验证明SO2具有漂白性和氧化性.

(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气.
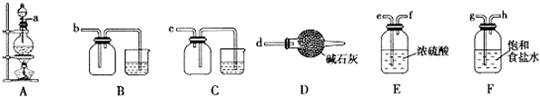
①装置A中发生反应的离子方程式为MnO2+4H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑2H2O.
②按气流方向由左到右,导管口连接顺序为a→g→h→e→f→b.
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气.
④向滤液A中通入Cl2,某同学取通入C12后的溶液滴加KSCN溶液,用来证明Cl2的氧化性比Fe3+强的结论.该实验设计是否合理否(填“是”或“否”),请用简要文字解释你的理由在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的.
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是92%(假设各步反应均完全进行且过程中无额外物质损耗).
分析 本题是实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程,涉及SO2的氧化性和还原性的检验,装置的连接及气密性的检验,还探究了如何证明铁红Fe2O3样品中含有FeO的实验设计,可借鉴Fe3+的检验及Fe2+与Fe3+的转化来实验,
(1)固体的焙烧在坩埚内进行;
(2)SO2通入品红溶液,证明SO2具有漂白性;SO2通入H2S溶液,生成S淡黄色沉淀,证明SO2具有氧化性;
(3)①MnO2与浓盐酸反应生成Cl2、MnCl2、H2O;
②生成的Cl2含有HCl、H2O,所以a连接g、h,通过饱和食盐水除去HCl、继续连接e、f,通过浓硫酸,除去H2O,再连接b,即可收集纯净、干燥的氯气;
③利用加热气体膨胀的原理进行装置气密性的检验,所以检验方法为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气;
④因为该检验方法是先通入氯气,再滴加KSCN溶液,在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的,所以该实验设计不合理;
(4)根据Fe元素守恒可得:2CuFeS2~Fe2O3,以此计算该黄铜矿中含CuFeS2的质量分数.
解答 解:(1)固体的焙烧在坩埚内进行,
故答案为:坩埚;
(2)SO2通入品红溶液,证明SO2具有漂白性;SO2通入H2S溶液,生成S淡黄色沉淀,证明SO2具有氧化性,
故答案为:漂白;氧化;
(3)①MnO2与浓盐酸反应生成Cl2、MnCl2、H2O,离子方程式为:MnO2+4H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑2H2O,
故答案为:MnO2+4H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑2H2O;
②生成的Cl2含有HCl、H2O,所以a连接g、h,通过饱和食盐水除去HCl、继续连接e、f,通过浓硫酸,除去H2O,再连接b,即可收集纯净、干燥的氯气,所以连接顺序为g→h→e→f→b,
故答案为:g→h→e→f→b;
③利用加热气体膨胀的原理进行装置气密性的检验,所以检验方法为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气,
故答案为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气;
④因为该检验方法是先通入氯气,再滴加KSCN溶液,在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的,所以该实验设计不合理,
故答案为:否;在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的;
(4)根据Fe元素守恒可得:2CuFeS2~Fe2O3,所以该黄铜矿中含CuFeS2的质量分数=$\frac{8g×368}{20g×160}$×100%=92%,
故答案为:92%.
点评 本题考查了物质制备过程分析判断,物质性质的理解应用,化学方程式和离子方程式书写方法,掌握基础是关键,题目难度较大.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案| A. | 电解饱和食盐水制取氢气 | |
| B. | 大量设立水电站,用电力分解水制取氢气. | |
| C. | 设法将太阳能聚焦,产生高温,使水分解产生氢气. | |
| D. | 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气. |
| A. | 标准状况下,11.2L的戊烷含有分子数为0.5NA | |
| B. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| C. | 1mol甘氨酸(α-氨基乙酸)分子中存在9NA对共用电子 | |
| D. | 1L0.1mol/L的苯酚分子数为0.1NA |
| A. | SO2、NO2和CO2都属于酸性氧化物 | |
| B. | 甲烷和和一氯甲烷都属于烷烃 | |
| C. | 碱性氧化物都是金属氧化物 | |
| D. | 在水溶液中能电离出H+的化合物都属于酸 |
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后,闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C、E、D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C、E、D于试管中,加稀NaOH 溶液并加热 | 加热前D的试管中闻 到特殊香味,加热后只有C仍有分层现象 |
A乙醇,B乙酸,C苯,D乙酸乙酯,E油脂,F葡萄糖溶液,G蔗糖溶液.
| A. | 强电解质在水中一定能全部溶解 | |
| B. | Cu能导电,因此Cu是电解质 | |
| C. | 弱电解质溶液的导电性可能比强电解质溶液的导电性强 | |
| D. | NaCl是电解质,故NaCl固体能导电 |
| A. | 相同条件下,硅甲烷的密度小于甲烷 | |
| B. | 硅甲烷燃烧生成二氧化硅和水 | |
| C. | 硅烷的分子通式可表示为SinH2n+2 | |
| D. | 硅甲烷与硅乙烷的相对分子质量相差30 |
| A. |  配制150mL 0.1 mol/L盐酸 | B. |  验证氨水呈碱性 | ||
| C. |  探究NaHCO3的热稳定性 | D. |  除去二氧化碳中的氯化氢 |