题目内容
17.有A、B、C、D四种元素的离子A+、B2+、C-、D2-,它们具有相同的电子数,下列判断中,正确的是( )| A. | A、B、C、D四种元素可能属于同一周期 | |
| B. | A、B、C、D四种元素一定属于短周期元素 | |
| C. | 原子序数由大到小的顺序是B>A>C>D | |
| D. | 离子半径由大到小的顺序是、B2+>A+>C->D2- |
分析 A+、B2+、C-、D2-四种离子具有相同的电子层结构,则原子序数B>A>C>D,A、B同周期,C、D同周期,且A、B处于C、D的下一周期,而同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:A+、B2+、C-、D2-四种离子具有相同的电子层结构,则原子序数B>A>C>D,A、B同周期,C、D同周期,且A、B处于C、D的下一周期,四元素可能均处于短周期,也可能处于长周期;
同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径A>B>D>C;
电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:D2->A+>C->B2+,
故ABD错误,C正确,
故选C.
点评 本题考查结构性质位置关系应用,难度中等,确定元素的相对位置是关键,注意掌握微粒半径比较规律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2 g H2所含原子数目为NA | |
| B. | 64 g SO2中含有的原子数为3 NA | |
| C. | 常温常压下,11.2 L Cl2含有的分子数为0.5 NA | |
| D. | 1 mol/L NaOH溶液中Na+的数目为NA |
8.下列说法中正确的是( )
| A. | 氯化钠水溶液在电流的作用下电离出Na+和Cl- | |
| B. | 二氧化碳的水溶液能够导电,故二氧化碳属于电解质 | |
| C. | 碳酸氢钠在水中电离的离子方程式为NaHCO3═Na++H++CO32- | |
| D. | 碳酸钠属于电解质 |
5.下列物质的分类依据、类别、性质三者之间对应关系完全正确的是( )
| 物质 | 分类依据 | 类别 | 性质 | |
| A | FeCl2 | 铁元素化合价 | 还原剂 | 可与O2、Zn等发生反应 |
| B | FeCl2 | 电离产生的微粒 | 盐 | 可发生水解反应,溶液显碱性 |
| C | HNO3 | 在水中能电离出H+ | 酸 | 可与CuO反应生成NO |
| D | HNO3 | 氮元素的化合价 | 氧化剂 | 可与Al、I-等发生反应 |
| A. | A | B. | B | C. | C | D. | D |
12.下列化学用语正确的是( )
| A. | 氯分子的电子式:Cl:Cl | B. | 水分子的电子式: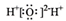 | ||
| C. | 氯离子的结构示意图: | D. | 质量数为37的氯原子:${\;}_{37}{\;}^{17}Cl$ |
2.以NA表示阿伏加德罗常数,下列说法错误的是( )
| A. | 每摩尔H2O2分子含2NA个氧原子 | |
| B. | 标准状况下,22.4L水中含有NA个水分子 | |
| C. | 16g甲烷分子中含4NA个氢原子 | |
| D. | 100mL 1mol/L Na2SO4溶液含有0.2NA个Na+ |
6.A、B、C、D、E是原子序数依次增大的短周期主族元素,A元素的最高正价与最低负价的绝对值相等,且存在多种同素异形体;C元素的两种同素异形体在紫外线作用下或氟利昂存在下可发生转化;D元素在周期表中族序数等于周期数;工业上常用A元素的某种单质高温还原E的氧化物制取E单质.下列说法中正确的是( )
| A. | 元素A的一种单质是太阳能电池中的主要材料 | |
| B. | 元素C的某单质与过氧化钠的漂白原理类似 | |
| C. | B和E可组成一种耐高温的结构材料,其化学式为E4B3 | |
| D. | 工业上制取E单质时,生成的气体主要是AO2 |
15.NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2L的戊烷含有分子数为0.5NA | |
| B. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| C. | 1mol甘氨酸(α-氨基乙酸)分子中存在9NA对共用电子 | |
| D. | 1L0.1mol/L的苯酚分子数为0.1NA |