题目内容
2.有关煤的叙述中,不正确的是( )| A. | 煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源 | |
| B. | 煤是由多种有机化合物组成的混合物,内含煤焦油等成分 | |
| C. | 煤除了含有C、H元素外,还含有少量的N、S、O等元素 | |
| D. | 煤等化石燃料的储量有限,节能和开发新能源是人类实现可持续发展的关键之一 |
分析 A、煤的干馏可以获得苯、甲苯和二甲苯;
B、煤中不含煤焦油;
C、煤是多种复杂的有机物和无机物组成的混合物;
D、煤属于化石燃料.
解答 解:A、煤的干馏可以获得苯、甲苯和二甲苯,是苯、甲苯和二甲苯的重要的工业来源,故A正确;
B、煤中不含煤焦油,煤焦油是通过煤的干馏获得的,故B错误;
C、煤是多种复杂的有机物和无机物组成的混合物,主要组成元素为C、H,还含有晒粮的N、S、O等元素,故C正确;
D、煤属于化石燃料,不可再生,故需节约使用,并开发新能源来实现能源的可持续发展,故D正确.
故选B.
点评 本题考查了煤的综合利用,应注意的是煤中不含苯、甲苯和煤焦油等,这些物质是通过煤的干馏产生的.

练习册系列答案
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
17.下列说法不符合人与自然和谐相处的是( )
| A. | 对农作物合理施用化肥 | B. | 对废旧电池进行回收处理 | ||
| C. | 将塑料垃圾埋入地下或者倾倒入海 | D. | 使用沼气、太阳能、风能等代替煤炭 |
7.配制480mL1.0mol•L-1NaNO2溶液,需称取溶质质量为( )
| A. | 13.8g | B. | 69g | C. | 34.5g | D. | 138g |
14.下列用来表示物质变化的化学用语中,正确的是( )
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-═Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
11.常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是A-+H2O?HA+OH-.(用反应的离子方程式表示),
(2)②组情况表明,c>0.2mol•L-1(选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)=c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明HA的电离程度>NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(2)②组情况表明,c>0.2mol•L-1(选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)=c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明HA的电离程度>NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
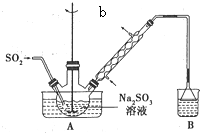 次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:
次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下: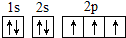 ,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).
,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).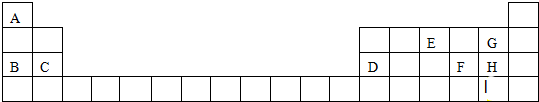
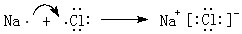 .
.