题目内容
13.W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z的基态原子核外有1个单电子,它的一种化合物常用来检验葡萄糖.(1)X位于元素周期表第三周期第ⅢA族.Y的第一电离能比X的大(填“大”或“小”).
(2)W的基态原子核外电子排布图是
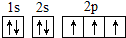 ,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).
,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
分析 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,则W为N元素、Y为S元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W,而小于Y,核外电子排布为1s22s22p63s23p1,所以X是Al元素;Z的基态原子核外有1个单电子,它的一种化合物常用来检验葡萄糖,则Z为Cu.
解答 解:W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,则W为N元素、Y为S元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W,而小于Y,核外电子排布为1s22s22p63s23p1,所以X是Al元素;Z的基态原子核外有1个单电子,它的一种化合物常用来检验葡萄糖,则Z为Cu.
(1)X为Al,核外电子排布为1s22s22p63s23p1,位于元素周期表第三周期第ⅢA族.非金属性越强,第一电离能越大,故第一电离能S>Al,
故答案为:三、ⅢA;大;
(2)W为N元素,基态核外电子排布为1s22s22p3,基态原子核外电子排布图是 ,由于氮元素非金属性比氧的弱,故W(氮)的气态氢化物稳定性比H2O(g)弱,
,由于氮元素非金属性比氧的弱,故W(氮)的气态氢化物稳定性比H2O(g)弱,
故答案为: ;弱;
;弱;
(3)Y的最高价氧化物对应水化物为硫酸,Cu与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
点评 本题考查结构由位置关系、核外电子排布、电离能、元素化合物等知识,能正确判断各元素是解本题的关键,注意基态原子核外电子排布式要遵循构造原理.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol•L-1醋酸溶液的pH比0.1mol•L-1盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢.
| A. | ②⑥ | B. | ③④⑤⑥ | C. | ③④⑥ | D. | ①② |
| A. |  1,4-二甲基丁烷 | B. | 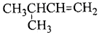 3-甲基丁烯 | C. | 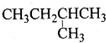 2-甲基丁烷 | D. | 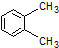 二甲苯 |
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小
B.用干燥的pH试纸测定氯水的pH
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌
D.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
E.观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察
F.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
(2)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处.
| 试剂 | 离子反应方程式 | |
| ①NaHCO3溶液(Na2CO3) | CO2 | CO2+H2O+CO32-=2HCO3- |
| ②Fe2O3(Al2O3) | NaOH溶液 | Al2O3+2OH-=2AlO2-+H2O |
| ③FeCl3溶液(FeCl2) | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| ④CO2(HCl) | 饱和的NaHCO3溶液 | HCO3-+H+=H2O+CO2↑ |
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为
 ;
;(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na;
(5)在 ⑦与 ⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| A. | 煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源 | |
| B. | 煤是由多种有机化合物组成的混合物,内含煤焦油等成分 | |
| C. | 煤除了含有C、H元素外,还含有少量的N、S、O等元素 | |
| D. | 煤等化石燃料的储量有限,节能和开发新能源是人类实现可持续发展的关键之一 |
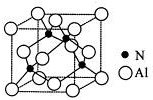
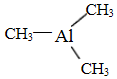 ,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).
,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).