题目内容
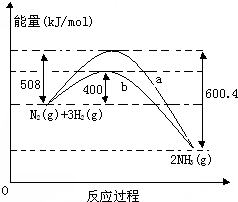 如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线.
如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线.(1)氮气与氢气反应生成氨气的热化学反应方程式为
(2)b曲线表示的是
(3)在同温同压下向密闭容器中通入1mol N2(g)与3mol H2(g),达到平衡时放出的热量为Q1 kJ.Q1
(4)在同温同压下向密闭容器中通入0.5mol N2(g)、1.5mol H2(g)和1mol NH3(g),达到平衡时放出的热量为Q2 kJ.Q1
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)据反应热等于反应物活化能和生成物活化能的差值,求出反应热,书写热化学方程式;
(2)催化剂能够降低反应的活化能;
(3)合成氨是可逆反应;
(4)反应物越多反应放热越多.
(2)催化剂能够降低反应的活化能;
(3)合成氨是可逆反应;
(4)反应物越多反应放热越多.
解答:
解:(1)据图分析,△H=反应物活化能-生成物活化能=508KJ/mol-600.4KJ/mol=-92.6KJ/mol,所以其热化学方程式为:3H2(g)+N2(g)?2NH3(g)△H=-92.4KJ/mol,故答案为:3H2(g)+N2(g)?2NH3(g)△H=-92.4KJ/mol;
(2)b曲线比a曲线只有活化能低,说明反应使用了催化剂,故答案为:有催化剂情况下反应过程中的能量变化;
(3)合成氨是可逆反应,1mol N2(g)与3mol H2(g)不能完全转化为氨气,所以发出的热量少于92.4KJ,故答案为:<;
(4)向密闭容器中通入0.5mol N2(g)、1.5mol H2(g)和1mol NH3(g),比通入1mol N2(g)与3mol H2(g),反应的氮气和氢气更少,放热就少,
故答案为:<.
(2)b曲线比a曲线只有活化能低,说明反应使用了催化剂,故答案为:有催化剂情况下反应过程中的能量变化;
(3)合成氨是可逆反应,1mol N2(g)与3mol H2(g)不能完全转化为氨气,所以发出的热量少于92.4KJ,故答案为:<;
(4)向密闭容器中通入0.5mol N2(g)、1.5mol H2(g)和1mol NH3(g),比通入1mol N2(g)与3mol H2(g),反应的氮气和氢气更少,放热就少,
故答案为:<.
点评:本题通过合成氨过程中能量变化,考查了热化学方程式书写、催化剂的催化原理、可逆反应的反应热,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述中正确的是( )
| A、将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| B、Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 |
| C、H2CO3的酸性比HClO弱,推出CO2通入NaClO溶液中不能生成HClO |
| D、SiO2是酸性氧化物,能与NaOH溶液反应 |
下列有关电解质溶液的叙述,不正确的是( )
| A、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 |
| B、在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
| C、在含有BaSO4沉淀的溶液中加入Na2SO4固体,溶液中c(Ba2+)减小 |
| D、常温下,pH=2的盐酸与pH=12的氨水等体积混合所得溶液c(H+)>c(OH-) |
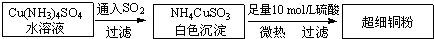
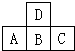 如图中A、B、C、D是短周期中同周期或同主族的相邻元素.
如图中A、B、C、D是短周期中同周期或同主族的相邻元素.