题目内容
20. ①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.
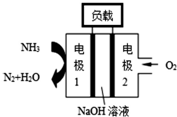
①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池如图所示,该燃料电池工作时,负极的电极反应式为2NH3+6OH--6e-═N2+6H2O;电池的总反应为4NH3+3O2=2N2+6H2O.
分析 ①负极发生氧化反应,锌失电子;根据1mol的锌失去2mol的电子进行计算;
②在燃料电池的负极上发生燃料氨气失电子的氧化反应,则碱性环境下电极1发生的电极反应为:2NH3+6OH--6e-=N2↑+6H2O,电池的总反应为4NH3+3O2=2N2+6H2O.
解答 解:①由反应2Zn+O2═2ZnO,锌发生氧化反应,所以锌是负极,当导线中有1mol电子通过时,理论上消耗的O2物质的量为:$\frac{1}{4}$mol,所以体积为:$\frac{1}{4}$mol×22.4L/mol=5.6L,故答案为:锌;5.6L;
②在燃料电池的负极上发生燃料氨气失电子的氧化反应,则碱性环境下电极1发生的电极反应为:2NH3+6OH--6e-=N2↑+6H2O②在燃料电池的负极上发生燃料氨气失电子的氧化反应,则碱性环境下电极1发生的电极反应为:2NH3+6OH--6e-=N2↑+6H2O,电池的总反应为4NH3+3O2=2N2+6H2O,故答案为:2NH3+6OH--6e-═N2+6H2O;4NH3+3O2=2N2+6H2O.
点评 本题考查燃料电池的工作原理和规律:负极上是燃料失电子的氧化反应,在正极上氧气发生得电子的还原反应,比较容易.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
11.下列反应的生成物只可能为纯净物的是( )
| A. | CH4与Cl2光照取代反应 | B. | 乙醇与浓硫酸共热 | ||
| C. | 乙炔在空气中的燃烧反应 | D. | 乙烯与氯化氢加成 |
8.常温时,ksp(CaC2O4)=2.4×10-9,下列有关0.10mol/L草酸钠溶液的说法,正确的是( )
| A. | 溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-) | |
| B. | 若向溶液中不断加水稀释,水的电离程度增大 | |
| C. | 若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a | |
| D. | 若向该溶液中加入等体积CaCl2溶液后能够产生沉淀,则CaCl2溶液的最小浓度应该大于2.4×10-8 mol/L |
5.下列化学用语正确的是( )
| A. | H2O2的电子式: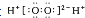 | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | 中子数为10的氧原子:${\;}_8^{10}O$ | D. | 乙酸乙酯的结构简式:C4H8O2 |
12.下列关于有机化合物的叙述正确的是( )
| A. | (NH4)2SO4浓溶液和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯中含有碳碳双键,其性质跟乙烯相似 | |
| C. | 乙烯使溴水褪色和苯与溴水混合振荡后水层变为无色原理相同 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
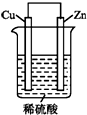 如图是Zn和Cu形成的原电池,回答下列问题:
如图是Zn和Cu形成的原电池,回答下列问题: .
.
 .
.