题目内容
9.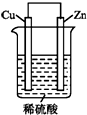 如图是Zn和Cu形成的原电池,回答下列问题:
如图是Zn和Cu形成的原电池,回答下列问题:(1)正极发生还原反应(选填“氧化”或“还原”),负极电极反应式为Zn-2e-=Zn2+.
(2)电子流动方向,从Zn电极(选填“Cu”或“Zn”),经外电路,流向另一电极.阳离子向Cu电极定向移动(选填“Cu”或“Zn”).
(3)有0.1mol电子流过导线,则产生H2在标准状况下的体积为1.12L,若是断开Zn和Cu之间的导线,产生气泡的速度减慢(选填“加快”、“不变”或“减慢”).
分析 在原电池中较活泼的金属作负极,失电子发生氧化反应,电子经导线传递到正极,电流与电子运动方向相反,溶液中阳离子移向正极,阴离子移向负极,Zn比Cu活泼,Zn做负极电极反应式为:Zn-2e-=Zn2+,铜作正极,氢离子得电子,电极反应式为:2H++2e-═H2↑,总反应离子方程式为:Zn+2H+═Zn2++H2↑,根据电极反应式分析求解.
解答 解:(1)在原电池中,铜作正极,氢离子得电子发生还原反应,较活泼金属Zn做负极,电极反应式为:Zn-2e-=Zn2+,
故答案为:还原;Zn-2e-=Zn2+;
(2)在原电池中较活泼的金属作负极,不活泼金属作正级,负极失电子,电子有负极经导线传递到正极,因为Zn比Cu活泼,Zn做负极,Cu作正极,所以电子由Zn到Cu;阳离子向正极Cu极流动,
故答案为:Zn;Cu;
(3)由于正极是氢离子得到电子,电极反应式为:2H++2e-═H2↑,2e-~H2,根据电子得失守恒可知:转移电子物质的量为0.1mol时,产生氢气0.05mol,在标况下所占体积为:0.05mol×22.4L•mol-1=1.12L,若是断开Zn和Cu之间的导线,不能形成原电池,反应速率减慢,
故答案为:1.12L;减慢.
点评 本题考查了原电池的相关知识,注意原电池的形成条件、电子守恒的应用,寻找两电极及正确书写电极反应式是解题的关键,题目难度中等.

练习册系列答案
相关题目
19.下列关于纸层析的说法中不正确的是( )
| A. | 纸层析以滤纸作为惰性支持物 | |
| B. | 应沿试管壁小心地将展开剂慢慢倒入试管底部 | |
| C. | 纸层析的实质是试样中的各组分在两相之间产生不同分配 | |
| D. | 点样后的滤纸需晾干后,才能将其浸入展开剂中 |
17.下列离子方程式书写正确的是( )
| A. | 石灰乳与碳酸钠溶液反应:Ca2++CO32-=CaCO3↓ | |
| B. | NH4HSO3溶液与足量的氢氧化钠溶液混合加热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O | |
| C. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- | |
| D. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ |
4.已知298K时,2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,下列说法正确的是( )( )
| A. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 向某恒容密闭容器中通入1mol SO2和0.5 molO2,达到平衡时放出热量为98.5 kJ | |
| C. | 升高温度能使逆反应速率加快,正反应速率减慢 | |
| D. | 向某恒容密闭容器中通入一定量的SO2和O2达到平衡后,再通入少量气体He,平衡不移动 |
18.下列关于有机化合物的结构、性质的叙述正确的是( )
| A. | 乙烯和苯都能使溴水层褪色,褪色的原因相同 | |
| B. | 淀粉、油脂、蛋白质都能水解,且都属于有机高分子化合物 | |
| C. | 蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体 | |
| D. | 乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有官能团“-OH” |
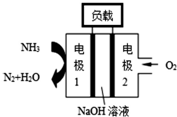 ①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.
①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.

 .
. .
. .
.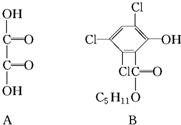 化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).
化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).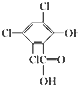 .
. 如图是铜与稀硝酸反应的实验装置,请回答下列问题:
如图是铜与稀硝酸反应的实验装置,请回答下列问题: